
【题目】根据所学知识完成问题:
(1)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2 (g)NH2COONH4(l)△H=﹣117kJmol﹣1
NH2COONH4(l)(NH2)2CO(g)+H2O(g)△H=+15kJmol﹣1
①由氨气和二氧化碳合成尿素的热化学方程式是:
②第一步反应在11.1Mpa、160°C的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低.因此,总反应的反应速率和转化率主要取决于 . (填“第一步”或“第二步”)
③对于第一步反应,能判断该反应一定达到化学平衡状态的依据是(填选项编号).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ正(NH3)=2υ逆(CO2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
(2)工业上合成氨气的反应为:N2(g)+3H2(g)2NH3(g)△H<0.现将10mol N2和26molH2置于容积可变的密闭容器中,N2的平衡转化率(α)与体系总压强(P)、温度(T)的关系如图所示.
回答下列问题:
①反应达到平衡状态B时,容器的容积10L,则T1时,合成氨反应的平衡常数K= .
②平衡状态由A变到C时,对应的平衡常数K(A)K(C)(填“>”、“<”或“=”).
③平衡状态由A变到B时,对应的平衡常数K(A)K(B)(填“>”、“<”或“=”).
【答案】
(1)2NH3(g)+CO2(g)?(NH2)2CO(g)+H2O(g)△H=﹣102kJ?mol﹣1;第二步;ABC
(2)0.025;>;=
【解析】解:(1)①2NH3(g)+CO2(g)NH2COONH4(l)△H=﹣117kJmol﹣1②NH2COONH4(l)(NH2)2CO(g)+H2O(g)△H=+15kJmol﹣1依据盖斯定律①+②得到2NH3(g)+CO2(g)(NH2)2CO(g)+H2O(g)△H=﹣102kJmol﹣1;
所以答案是:2NH3(g)+CO2(g)(NH2)2CO(g)+H2O(g)△H=﹣102kJmol﹣1;②第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低,总反应的反应速率和转化率主要取决于第二步;
所以答案是:第二步;③对于第一步反应,2NH3(g)+CO2(g)NH2COONH4(l)△H=﹣117kJmol﹣1 , 能判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,各组分浓度保持不变;A.反应前后气体质量变化,物质的量变化,所以容器中气体的平均相对分子质量不随时间而变化,证明反应达到平衡状态,故A正确;B.依据反应速率之比等于化学方程式计量数之比,表示的是正反应速率之比,υ正(NH3)=2υ逆(CO2),说明二氧化碳正反应速率和逆反应速率相同,故B正确;C.反应生成液体,气体质量变化,体积不变化,容器中气体的密度不随时间而变化,能说明反应达到平衡状态,故C正确;D.NH2COONH4①是液体,密闭容器中容器中的总质量守恒,容器中总质量不随时间而变化,不能说明反应达到平衡状态,故D错误;
所以答案是:ABC;
②①反应达到平衡状态B时,氮气的转化率为20%,容器的容积10L,N2(g)+3H2(g)═2NH3(g)起始量(mol/L)1 2.6 0变化量(mol/L) 1×20%=0.2 0.6 0.4 平衡量(mol/L) 0.82 0.4K= ![]() =0.025,所以答案是:0.025;
=0.025,所以答案是:0.025;
②N2(g)+3H2(g)═2NH3(g)△H<0,反应是放热反应,温度越低平衡正向进行,氮气转化率增大,图象分析判断T1<T2 , 衡状态由A变到C时,温度升高平衡常数减小,所以平衡常数K(A)>K(C),
所以答案是:>;③化学平衡常数只受温度的影响,温度不变,则K不变,所以答案是:=.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡状态的判断(状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等)的相关知识才是答题的关键.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某有机物的蒸汽完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的二氧化碳该有机物可能是( )
A.C2H6
B.C2H5OH
C.C2H4O
D.C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.标准状况下,11.2 L SO3中含有0.5NA个SO3分子
B.48g O3气体含有3NA个氧原子
C.在1L0.5molL﹣lFeCl3溶液中含有0.5NA个Fe3+
D.1.5 mol NO2与足量水反应,转移的电子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3 ![]() 2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
2Fe+Al2O3 , 反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的反应.
(2)信息中的“某些”指(填“比铝活泼的”“比铝不活泼的”或“任意”).
(3)试写出铝粉与MnO2发生的铝热反应方程式 .
(4)铝热反应可用于野外焊接钢轨,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的下列各电解质处于以下状态时:①熔融的NaHSO4 ②NaHSO4水溶液 ③NaHCO3水溶液 ④H2CO3溶液,自由移动的离子数目由大到小的排列顺序正确的是
A. ②③①④ B. ④②③① C. ①②③④ D. ②①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 , 属于非电解质的有 .
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 .
(3)除去③中少量②的操作是 , 化学方程式为 .
(4)标准状况下,L④中含有0.4mol 氧原子.
(5)现有100mL⑩溶液中含Fe3+5.6g,则溶液中SO42﹣的物质的量浓度是 .
(6)若在⑦中缓慢加入⑥,产生的现象是 .
(7)将①加入到⑧中,⑧的导电能力变化为(填“增强”、“减弱”或“基本不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐
B. CO2通入到水玻璃中可以得到硅酸沉淀
C. SiO2是一种空间立体网状结构的晶体,熔点高,硬度大
D. 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,可用右侧示意图表示的是
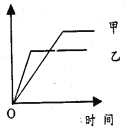
反应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量氨,在同一容器中:2NH3 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 |
C | 体积比为1︰3的N2、H2,在体积可变的恒压容器中: N2+3H2 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2mol SO2与1mol O2,在相同温度下:2SO2+O2 | SO3的物质的量 | 10 MPa | 20 MPa |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com