
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③⑥⑦B.①④⑥⑦C.②③④⑦D.①②④⑥
【答案】B
【解析】
在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,利用化学平衡状态的特征"等”、“定”来判断反应达到平衡状态。
①、单位时间内生成nmolO2的同时生成2n molNO2,说明正逆反应速率的相等,该反应达到平衡状态,故①正确;
②、单位时间内生成nmolO2的同时生2n molNO,只能说明单方向关系,不能说明正逆反应速率的关系,故②错误;
③、用NO2、NO、O2表示的反应速率的比为2:2:1的状态,反应进行到任何时刻都成立的关系,不能说明达到了平衡,故③错误;
④、混合气体的颜色不变化,说明二氧化氮的浓度不变化,该反应达到平衡状态,故④正确;
⑤、该反应是一个反应前后气体的质量不会改变的化学反应,混合气体的质量是守恒的,容器的体积不变,导致混合气体的密度不再变化,所以该反应不一定达到平衡状态,故⑤错误;
⑥、因该反应是物质的量在增大的化学反应,物质的量与压强成正比,则混合气体的压强不随时间的变化而变化,达到平衡状态,故⑥正确;
⑦、混合气体的平均相对分子质量=![]() ,混合气体的总质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,故⑦正确;
,混合气体的总质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,故⑦正确;
故选B。


科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125molL-1min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是
与温度(t)的关系曲线如右图。下列说法正确的是

A. 通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B. CO不适宜用于工业冶炼金属Cr
C. CO还原PbO2的反应ΔH>0
D. 工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的一组是( )
①.制取漂白液的反应原理: Cl2+2OH-=== Cl-+ClO-+ H2O
②.铁粉加入到三氯化铁溶液中: Fe3+ +Fe === 2Fe2+
③.NaHCO3溶液中加入稀盐酸:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
④.向澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=== CaCO3↓+H2O
⑤.硫酸铝溶液与足量的氨水混合反应: Al3+ + 4OH- === AlO2-+ H2O
⑥.过量氯水与FeCl2溶液作用: 2Fe2++Cl2 ==2 Fe3++2Cl-
A. ①②③ B. ③⑥ C. ①③⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如图:
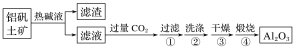
①滤液中通入过量CO2时主要反应的离子方程式是___。
②煅烧生成氧化铝的化学方程式是___。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是___(填字母)。
A. Al2O3属于电解质 B. Al2O3属于离子化合物
C. Al2O3属于碱性氧化物 D. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液的物质的量浓度等于0.1mol/L的是( )
A. 将0.1mol氨气充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将8g三氧化硫溶于水并配成1L溶液
D. 将0.1mol氧化钾溶于水并配成1L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向如图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是 ( )
A | B | C | D | |
X | SO2 | H2S | CO2 | Cl2 |
Y | 饱和NaHCO3 | 浓硫酸 | Na2SO3 | NaHCO3 |

A.A正确B.B正确C.C正确D.D正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可将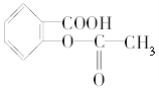 转变为
转变为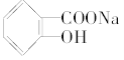 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液 ③加热溶液,通入足量的SO2 ④与稀H2SO4共热后,加入足量的NaHCO3
A.①②
B.①④
C.②③
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com