
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如图:
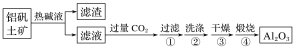
①滤液中通入过量CO2时主要反应的离子方程式是___。
②煅烧生成氧化铝的化学方程式是___。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是___(填字母)。
A. Al2O3属于电解质 B. Al2O3属于离子化合物
C. Al2O3属于碱性氧化物 D. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:________。
【答案】AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 2Al(OH)3![]() Al2O3+3H2O AB 阳极反应式是2O2--4e-=O2↑,在高温条件下,反应产生的氧气会与石墨反应生成CO2气体而不断消耗阳极材料,故阳极应不断补充。
Al2O3+3H2O AB 阳极反应式是2O2--4e-=O2↑,在高温条件下,反应产生的氧气会与石墨反应生成CO2气体而不断消耗阳极材料,故阳极应不断补充。
【解析】
(1)氧化铝为两性氧化物,铝矾土矿加入氢氧化钠溶液,氧化铝与NaOH溶液反应生成可溶性的偏铝酸钠,将不能反应的杂质过滤除去,然后向滤液中通入过量的二氧化碳可生成氢氧化铝沉淀,将沉淀经过滤、洗涤、干燥得纯净Al(OH)3,Al(OH)3煅烧可得到Al2O3;
(2) Al2O3为离子化合物,在熔融状态下可导电,Al2O3可用于冶炼铝,电解时,单质铝在阴极生成,阳极生成O2,如用石墨作阳极,则氧气与碳反应生成二氧化碳而不断消耗,应不断补充。
(1)①滤液中含有NaAlO2,向偏铝酸钠溶液中通入足量二氧化碳气体,反应生成氢氧化铝沉淀,同时生成碳酸氢根离子,反应的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
②Al(OH)3不稳定,加热分解生成氧化铝和水,反应的方程式为2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(2)①A. Al2O3在熔融状态下能够电离产生Al3+、O2-,因而在熔融状态下可导电,所以Al2O3属于电解质,A正确;
B. Al2O3在熔融状态可断裂离子键,能够电离产生Al3+、O2-,所以Al2O3是离子化合物,B正确;
C. Al2O3既能与酸反应产生盐和水,也能与碱反应产生盐和水,所以Al2O3属于两性氧化物,C错误;
D. Al2O3的离子之间以强烈的离子键结合,断裂消耗很高能量,所以Al2O3的熔点很高,故可作耐火材料,D错误;
故合理选项是AB;
②电解时Al3+在阴极得到电子变为单质Al,所以金属铝在阴极生成;O2-在阳极失去电子变为O2产生,阳极反应式是2O2--4e-=O2↑,如用石墨作阳极,则反应产生的氧气会与阳极上的碳反应生成CO2气体而不断消耗,故阳极石墨应不断补充。


科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈___色。因为___。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈__色,因为___。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡___(填“向左移动”或“向右移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③⑥⑦B.①④⑥⑦C.②③④⑦D.①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是
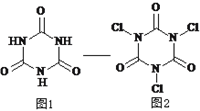
A. 氰尿酸的分子式为C6N3O3H3
B. HClO的电子式为 ![]()
C. 该转化过程有机物发生还原反应
D. 氰尿酸和次氯酸反应的物质的量之比为2 : 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2S是火法炼铜的重要原料之一,如图是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图。
Cu2S![]() Cu
Cu![]() Cu2O、CuO
Cu2O、CuO![]() A
A![]() B
B![]() 胆矾
胆矾
(1)Cu2S中铜元素的化合价为___,火法炼铜的反应原理是__________(用化学方程式表示)。
(2)向Cu2O、CuO中加入足量稀硫酸得到的体系A中溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式____________。
(3)若将A中红色物质反应掉,操作Ⅰ中加入的试剂最好是___(填字母序号)。
A.适量的NaNO3
B.适量的HNO3
C.适量的H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH由2变为1(体积变化忽略不计),此时电解过程中转移电子的物质的量是_____。
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示。通过计算确定258℃时发生反应的化学方程式:____,e点对应物质的化学式为_____(计算过程略去)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:
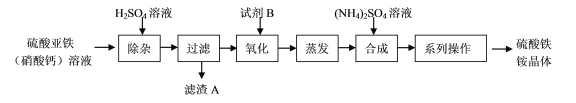
下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4C1晶体析出。
(1)如图所示装置的连接顺序是:a接__;__接__;b接__(填接口编号)。

(2)A中常选用的固体反应物为___;D中应选用的液体为__。
(3)第二步中必须先让___装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是___;装有无水CaCl2的U形管的作用是__。
(5)第三步分离出NaHCO3固体的操作是__。
(6)第四步中所加固体粉末化学式为___;所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,证明所得晶体大部分是NH4C1。简要写出操作和现象:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com