
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈___色。因为___。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈__色,因为___。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡___(填“向左移动”或“向右移动”)。
【答案】黄 OH-与H+结合生成水,c(H+)减小,使平衡向右移动,CrO42-浓度增大,溶液由橙黄色变为黄色 橙 c(H+)增大,平衡左移,Cr2O72-浓度增大,溶液又由黄色变为橙色 向右移动
【解析】
根据外界条件对平衡状态的影响分析解答。
(1)加入NaOH溶液,OH-与H+结合生成水,使c(H+)减小,平衡正向移动,因此溶液的颜色由橙色变为黄色;
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,增大了c(H+),平衡逆向移动,溶液颜色由黄色变为橙色;
(3)向原溶液中加入Ba(NO3)2溶液,Ba2+与CrO42-结合生成BaCrO4黄色沉淀,使c(CrO42-)减小,平衡向右移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为____________,形成该分散系的微粒直径范围是_________。
(3)电子工业需用30%FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式_________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气、②铁粉、③浓硝酸、④浓盐酸、⑤烧碱、⑥浓氨水,需用用到的一组试剂是__________。
A. ①②④ B. ①③④⑥ C. ②④⑤ D. ①④⑥
(4)高铁酸钠Na2FeO3是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为__________。
②高铁酸钠在水中可以发生如下反应:FeO42-+10H2O=4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有_____性,而能够除去水中悬浮物是因为________。
③下列物质能作净水削的有_________。
a.KAl(SO4)2·12H2O b.聚合硫酸铁[Fe(OH)(SO4)]n c.ClO2 d.“84消毒液”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含![]() 的气体会形成酸雨,危害环境.
的气体会形成酸雨,危害环境.
(1)在大气中![]() 形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
(2)钠碱循环法用![]() 溶液作为吸收液,可脱除烟气中
溶液作为吸收液,可脱除烟气中![]() ,吸收液吸收
,吸收液吸收![]() 的过程中,pH随
的过程中,pH随![]() :
:![]() 变化关系如下表:
变化关系如下表:
| 91:9 | 1:1 | 9:91 |
pH |
|
|
|
判断![]() 溶液显 ______ 性,用化学平衡原理解释 ______ ;
溶液显 ______ 性,用化学平衡原理解释 ______ ;
(3)当吸收液的pH降至约为6时,送至电解槽中,电解槽的阳极室中是稀硫酸,则![]() 在阳极放电的电极反应式是 ______ ;
在阳极放电的电极反应式是 ______ ;
(4)若用烧碱溶液吸收![]() ,①向100mL
,①向100mL![]() 溶液中不断通入一定量
溶液中不断通入一定量![]() 充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按
充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按![]()
![]() 、
、![]() ,Ⅱ.______ ,Ⅲ
,Ⅱ.______ ,Ⅲ![]() 、
、![]() ,Ⅳ.______ ;
,Ⅳ.______ ;
②若要验证白色固体X是第I种组成,依次加入的试剂为 ______ ![]() 填序号字母
填序号字母![]() .
.
![]() 盐酸
盐酸![]()
![]() 溶液
溶液![]() 溶液
溶液![]()
![]() 溶液
溶液![]() 酚酞试液
酚酞试液
(5)常温下将![]() 转化为
转化为![]() 而实现
而实现![]() 的处理.含
的处理.含![]() 的废气通入含
的废气通入含![]() 、
、![]() 的溶液时其中一个反应的离子方程式为
的溶液时其中一个反应的离子方程式为![]() ,则另一反应的离子方程式 ______ .
,则另一反应的离子方程式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温条件下向20mLNaOH溶液中逐滴加入0.1mol·L-1的醋酸溶液,滴定曲线如图所示。下列判断中,正确的是( )(忽略前后体积的变化)

A.在M点,两者恰好反应完全
B.滴定前,酸中c(H+)等于碱中c(OH-)
C.在N点,c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)
D.NaOH溶液的物质的量浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的一组是( )
①.制取漂白液的反应原理: Cl2+2OH-=== Cl-+ClO-+ H2O
②.铁粉加入到三氯化铁溶液中: Fe3+ +Fe === 2Fe2+
③.NaHCO3溶液中加入稀盐酸:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
④.向澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=== CaCO3↓+H2O
⑤.硫酸铝溶液与足量的氨水混合反应: Al3+ + 4OH- === AlO2-+ H2O
⑥.过量氯水与FeCl2溶液作用: 2Fe2++Cl2 ==2 Fe3++2Cl-
A. ①②③ B. ③⑥ C. ①③⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如图:
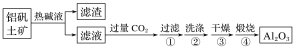
①滤液中通入过量CO2时主要反应的离子方程式是___。
②煅烧生成氧化铝的化学方程式是___。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是___(填字母)。
A. Al2O3属于电解质 B. Al2O3属于离子化合物
C. Al2O3属于碱性氧化物 D. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池工作时,下列叙述不正确的是
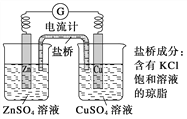
A. 负极反应为Zn-2e-===Zn2+
B. 电池反应为Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从铜电极流向锌电极
D. 盐桥中的K+移向CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500 ℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g) ![]() 4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
②4NH3(g)+4O2(g) ![]() 2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
③4NH3(g)+3O2(g) ![]() 2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
A.增大O2浓度
B.使用合适的催化剂
C.减小压强
D.降低温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com