
【题目】直接排放含![]() 的气体会形成酸雨,危害环境.
的气体会形成酸雨,危害环境.
(1)在大气中![]() 形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
(2)钠碱循环法用![]() 溶液作为吸收液,可脱除烟气中
溶液作为吸收液,可脱除烟气中![]() ,吸收液吸收
,吸收液吸收![]() 的过程中,pH随
的过程中,pH随![]() :
:![]() 变化关系如下表:
变化关系如下表:
| 91:9 | 1:1 | 9:91 |
pH |
|
|
|
判断![]() 溶液显 ______ 性,用化学平衡原理解释 ______ ;
溶液显 ______ 性,用化学平衡原理解释 ______ ;
(3)当吸收液的pH降至约为6时,送至电解槽中,电解槽的阳极室中是稀硫酸,则![]() 在阳极放电的电极反应式是 ______ ;
在阳极放电的电极反应式是 ______ ;
(4)若用烧碱溶液吸收![]() ,①向100mL
,①向100mL![]() 溶液中不断通入一定量
溶液中不断通入一定量![]() 充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按
充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按![]()
![]() 、
、![]() ,Ⅱ.______ ,Ⅲ
,Ⅱ.______ ,Ⅲ![]() 、
、![]() ,Ⅳ.______ ;
,Ⅳ.______ ;
②若要验证白色固体X是第I种组成,依次加入的试剂为 ______ ![]() 填序号字母
填序号字母![]() .
.
![]() 盐酸
盐酸![]()
![]() 溶液
溶液![]() 溶液
溶液![]()
![]() 溶液
溶液![]() 酚酞试液
酚酞试液
(5)常温下将![]() 转化为
转化为![]() 而实现
而实现![]() 的处理.含
的处理.含![]() 的废气通入含
的废气通入含![]() 、
、![]() 的溶液时其中一个反应的离子方程式为
的溶液时其中一个反应的离子方程式为![]() ,则另一反应的离子方程式 ______ .
,则另一反应的离子方程式 ______ .
【答案】![]() 、
、![]() 酸性
酸性 ![]() 在溶液中存在如下两平衡:
在溶液中存在如下两平衡:![]() 、
、![]() ,由表中数据可知,当
,由表中数据可知,当![]() :
:![]() :91时,溶液中主要存在
:91时,溶液中主要存在![]() ,此时
,此时![]() 溶液显酸性,证明
溶液显酸性,证明![]() 的电离程度大于水解程度
的电离程度大于水解程度 ![]()
![]()
![]() cb
cb ![]()
【解析】
(1)根据二氧化硫的性质及酸雨形成原理分析解答;(2)根据题给信息中pH判断溶液酸碱性,并用平衡移动原理分析;(3)根据电解原理分析电极反应式;(4)①由于![]() 和NaOH反应时物质的量之比不同则产物不同,故可根据
和NaOH反应时物质的量之比不同则产物不同,故可根据![]() 和NaOH反应时物质的量之比对产物进行讨论;②根据离子检验原理分析解答;(5)根据氧化还原反应原理分析解答。
和NaOH反应时物质的量之比对产物进行讨论;②根据离子检验原理分析解答;(5)根据氧化还原反应原理分析解答。
(1)在大气中![]() 形成硫酸型酸雨有二种途径,其中一种途径为:
形成硫酸型酸雨有二种途径,其中一种途径为:![]() 、
、![]() , 故答案为:
, 故答案为:![]() 、
、![]() ;
;
(2)由于![]() 在溶液中存在如下两平衡:
在溶液中存在如下两平衡:![]() 、
、![]() ,由表中数据可知,当
,由表中数据可知,当![]() :
:![]() :91时,溶液中主要存在
:91时,溶液中主要存在![]() ,此时
,此时![]() 溶液显酸性,证明
溶液显酸性,证明![]() 的电离程度大于水解程度,故答案为:酸性;
的电离程度大于水解程度,故答案为:酸性;![]() 在溶液中存在如下两平衡:
在溶液中存在如下两平衡:![]() 、
、![]() ,由表中数据可知,当
,由表中数据可知,当![]() :
:![]() :91时,溶液中主要存在
:91时,溶液中主要存在![]() ,此时
,此时![]() 溶液显酸性,证明
溶液显酸性,证明![]() 的电离程度大于水解程度;
的电离程度大于水解程度;
(3)当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:![]() , 故答案为:
, 故答案为:![]() ;
;
(4)由反应方程式![]() ①、
①、![]() ②可知
②可知
![]() :
:![]() 时产物为
时产物为![]() ,
,![]() :
:![]() 时产物为
时产物为![]() ,
,
所以![]() :
:![]() 时,NaOH过量则产物为
时,NaOH过量则产物为![]() ;
;![]() :
:![]() 时,对于①反应来说二氧化硫过量而对于②反应来说二氧化硫的量不足,所以产物为
时,对于①反应来说二氧化硫过量而对于②反应来说二氧化硫的量不足,所以产物为![]() ;
; ![]() :
:![]() 时,二氧化硫过量,则固体产物为
时,二氧化硫过量,则固体产物为![]() ,向100mL
,向100mL ![]() 烧碱溶液中不断通入一定量
烧碱溶液中不断通入一定量![]() 充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是:NaOH、
充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是:NaOH、![]() ;
;![]() ;
;![]() 、
、![]() ;
;![]() ; 故答案为:
; 故答案为:![]() ;
; ![]() ;
;
②验证白色固体X是第I种组成NaOH、![]() ,需要验证亚硫酸根离子和氢氧根离子,可以先加入
,需要验证亚硫酸根离子和氢氧根离子,可以先加入![]() 溶液检验亚硫酸根离子,后加入
溶液检验亚硫酸根离子,后加入![]()
![]() 溶液检验氢氧化钠,或先加入过量
溶液检验氢氧化钠,或先加入过量![]() 溶液检验亚硫酸钠,然后加入
溶液检验亚硫酸钠,然后加入![]() 酚酞试液检验氢氧化钠, 故答案为:
酚酞试液检验氢氧化钠, 故答案为:![]() 或
或![]() ;
;
(5)常温下将![]() 转化为
转化为![]() 而实现
而实现![]() 的处理.含
的处理.含![]() 的废气通入含
的废气通入含![]() 、
、![]() 的溶液时其中一个反应的离子方程式为:
的溶液时其中一个反应的离子方程式为:![]() ,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:
,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液_____________________、_______________________、过滤、洗涤干燥得FeCl3·6H2O;再______________________________,得到无水FeCl3。
(2)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=______mol·L-1(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(3)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
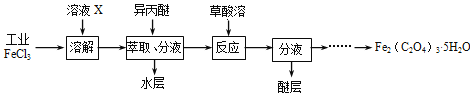
①为抑制FeCl3水解,溶液X为______________。
②所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是____________________________。
③为测定所得草酸铁晶体的纯度,实验室称取ag样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_________(填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是___________。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法正确的是( )
NaCoO2+Cn。下列说法正确的是( )
A.放电时,Na+向负极移动
B.放电时,正极的电极反应式为NamCn-me-=mNa++Cn
C.充电时,阴极质量减小.
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1'NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法正确的是( )

A.OC段离子反应方程式为NH4++OH-=NH3·H2O
B.溶液中n(NH4+)=0.012mol
C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是过滤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

下列说法正确的是 ( )
A.苛性钾溶液中KOH的质量是4.94g
B.ClO-的生成是由于温度升高引起的
C.氧化性ClO-<ClO3-
D.反应中转移电子的物质的量是0.21mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈___色。因为___。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈__色,因为___。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡___(填“向左移动”或“向右移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:
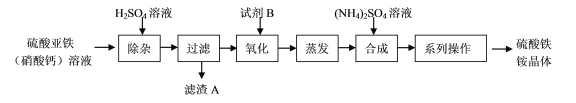
下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com