
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂电池充电时阳极反应式为:LiFePO4 -xLi+ -xe-→ xFePO4 + (1-x)LiFePO4。放电工作示意图如下图。下列叙述不正确的是

A.放电时,Li+ 通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:FePO4 + xLi+ + xe-→ xLiFePO4 + (1-x)FePO4
D.该电池充放电过程通过Li+ 迁移实现,C、Fe、P元素化合价均不发生变化
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.28g聚乙烯中含有NA个碳碳双键
B.1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗Cl2分子数最多为6 NA
C.标准状况下,2.24L CCl4中的原子总数大于0.5 NA
D.17g羟基中含有的电子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为__。下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是_____。
A.C7H8 B.C6H14 C.C7H14 D.C8H8
(2)若烃A分子中所有的碳原子在同一平面上,且该分子的一氯取代物只有一种。则A的结构简式为__。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】染料化工企业产生的废水中含有高浓度的氨氮(氨和铵盐)成分,直接排放会造成环境污染。实验小组探索下列方法对氨氮废水进行处理。

(1)实验室检测上述废水中是否含有氨氮的方法是___。
(2)“吹脱”步骤中,在废水池的底部吹入大量热气泡,其目的是___。
(3)“氧化”步骤中加入了微生物,NH3被氧化为N2。反应的化学方程式为___。
(4)“沉淀"步骤中将剩余的NH3·H2O转化为NH4MgPO46H2O沉淀,发生反应的离子方程式为___。NH4MgPO46H2O在农业生产中具有重要应用价值,其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法符合原子经济性原理的是
A.SO3与H2O反应制取硫酸:SO3+H2O=H2SO4
B.用氢氧化钠溶液吸收SO2:SO2+2NaOH=Na2SO3+H2O
C.CO2与H2反应制取甲醇:CO2+3H2 CH3OH+H2O
CH3OH+H2O
D.H2还原氧化铜:H2+CuO![]() Cu+H2O
Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
A.①⑥B.①⑤⑥C.②③④⑥D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
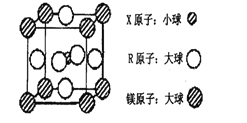
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com