
����Ŀ����2 L�ܱ�������ͨ��a mol����A��b mol����B����һ�������·�����Ӧ��xA(g)��yB(g) ![]() pC(g)��qD(g)����֪��ƽ����Ӧ����vC=
pC(g)��qD(g)����֪��ƽ����Ӧ����vC=![]() vA����Ӧ2 minʱ��A�����ʵ���������
vA����Ӧ2 minʱ��A�����ʵ���������![]() ��B�����ʵ���������
��B�����ʵ���������![]() mol����a mol D���ɡ�
mol����a mol D���ɡ�
�ش��������⣺
��1����Ӧ2 min�ڣ�vA=________��vB=________��
��2����ѧ����ʽ�У�x=________��y=__________��p=__________��q=________��
��3����Ӧƽ��ʱ��DΪ2a mol����B��ת����Ϊ________��
��4�����ֻ���߷�Ӧ�¶ȣ�������Ӧ�������䣬ƽ��ʱDΪ1.5a mol����÷�Ӧ����H________0��(������������������=��)
��5����������������䣬���������ݻ���Ϊ1 L������ͬ����ʵ�飬����������Ӧ�Ƚϣ��ٷ�Ӧ����________(��������������С������������)��������_____________________��
��ƽ��ʱ��Ӧ���ת����________(��������������С������������)��������__________________��
���𰸡�![]() mol��(L��min)1
mol��(L��min)1 ![]() mol��(L��min)1 2 3 1 6
mol��(L��min)1 2 3 1 6 ![]() ��100% �� ���� �����С����Ӧ���Ũ���������ʹ��Ӧ�������� ��С �����С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С
��100% �� ���� �����С����Ӧ���Ũ���������ʹ��Ӧ�������� ��С �����С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С
��������
��1����Ӧ2 min�ڣ�vA=c/t=a/3/(2��2)=![]() mol��(L��min)1 ��vB=c/t= a/2/(2��2)=
mol��(L��min)1 ��vB=c/t= a/2/(2��2)= ![]() mol��(L��min)1������������������ǣ�
mol��(L��min)1������������������ǣ� ![]() mol��(L��min)1 ��
mol��(L��min)1 �� ![]() mol��(L��min)1��
mol��(L��min)1��
(2) �ɣ�1����֪��vA=![]() mol��(L��min)1��vB=
mol��(L��min)1��vB= ![]() mol��(L��min)1��ͬ���ɵ�vD��a/(2��2)mol��L��1��min��1��vC��1/2vA��a/24mol��L��1��min��1���ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ�л�ѧ������֮�ȿɵ�x��y��p��q��vA��vB��vC��vD��a/12:a/8:a/24:a/4=2:3:1:6�����Ի�ѧ����ʽ�У�x=2��y=3��p=1��q=6������������������ǣ�2�� 3 ��1 ��6��
mol��(L��min)1��ͬ���ɵ�vD��a/(2��2)mol��L��1��min��1��vC��1/2vA��a/24mol��L��1��min��1���ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ�л�ѧ������֮�ȿɵ�x��y��p��q��vA��vB��vC��vD��a/12:a/8:a/24:a/4=2:3:1:6�����Ի�ѧ����ʽ�У�x=2��y=3��p=1��q=6������������������ǣ�2�� 3 ��1 ��6��
��3��2A(g)��3B(g)![]() C(g)��6D(g)��Ӧƽ��ʱ��DΪ2a mol����B��С��a mol�����B��ת����Ϊa/b��100%=a/b��100%��������������������� a/b��100%��
C(g)��6D(g)��Ӧƽ��ʱ��DΪ2a mol����B��С��a mol�����B��ת����Ϊa/b��100%=a/b��100%��������������������� a/b��100%��
(4)������������ֻ�����¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ���������֪ԭƽ��ʱDΪ2amol�������¶ȴﵽ��ƽ��ʱ��DΪ1.5amol���ɼ���Ӧ���淴Ӧ�����ƶ����������Ӧ�Ƿ��ȷ�Ӧ������H<0������������������ǣ�����
(5) ��ԭ�ܱ����������Ϊ2 L���ֱ�Ϊ1 L�������������䣬��Ӧ����������Ũ�ȶ�������˷�Ӧ������������������������ǣ����������С����Ӧ���Ũ���������ʹ��Ӧ��������
�ڼ�С�����Ϊ��ѹ������ѹǿ��ƽ��Ӧ�����������֮��С�ķ����ƶ������ڷ�Ӧ����ʽΪ2A(g)��3B(g)![]() C(g)��6D(g)��������������֮��С�����ƽ�������ƶ�����Ӧ���ת���ʼ�С������������������ǣ���С�������С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С��
C(g)��6D(g)��������������֮��С�����ƽ�������ƶ�����Ӧ���ת���ʼ�С������������������ǣ���С�������С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���й����ʵ���Ũ�ȹ�ϵ��ȷ����
A. Na2S ��Һ�� c��OH����=c��H+��+c��HS����+2c��H2S��
B. Na2CO3��Һ�У�c��Na+��=2c��CO32����+2c��HCO3����
C. �����£�pH=1��CH3COOH��Һ��pH=13��NaOH��Һ������������Һ������Ũ�ȵĴ�С˳��c��Na+����c��CH3COO������c��OH������c��H+��
D. pH=4��0.1molL��1NaHC2O4��Һ��c��H C2O4������c��H+����c��H2C2O4����c��C2O42����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ�����CO2��H2�ڴ����������ºϳɼ״�����Ҫ�����ķ�Ӧ���£�
��Ӧ����CO2(g)+3H2(g)CH3OH(g)+H2O(g) H1=-53.7 kJmol-1
��Ӧ����CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1
(1)��֪��ѧ���ļ������£�

�ٷ�Ӧ����CO(g)+ 2H2(g) CH3OH(g) H3=_____________��
��̼��˫���ļ���Ϊ__________________��
����ijһ�����£�������Ӧͬʱ����������ӦI����III�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2��K3����K2=____________________(�ú�K1��K3����ʽ��ʾ)��
(2)�о��������ڴ��������£�CO2��H2�ɷ�����ӦI�͢�ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1��2��2��������ͬ��Ӧʱ��������ʵ������(�״�ѡ���Լ�ת����CO2�����ɼ״��İٷ���)��
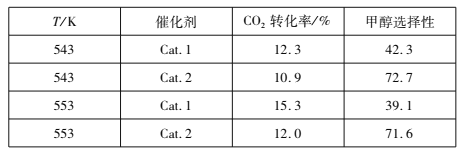
��543 Kʱ��ʹ�ô���Cat��2�����ʵ������ʱ��ӦI������״̬Ϊ________________(���������С�����ƽ��״̬������������С�)��
����������߷�ӦI��H2ƽ��ת���ʵĴ�ʩ��___________(����)��
A��ʹ�ô���Cat��1 B�����ͷ�Ӧ�¶�
C��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�� D����СCO2��H2�ij�ʼͶ�ϱ�

(3)��������Ӧ�У��������CO��CO2��H2����ɹ�ϵΪn(H2)��n(CO+ CO2)=2.60ʱ����ϵ�е�COƽ��ת���ʦ�(CO)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
��ͼ�е�ѹǿ�ɴ�С��˳��Ϊ____________��
�ڦ�(CO)ֵ���¶����߶���С��ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������ȵĹ̶��ݻ����ܱ������п��淴ӦmA(g)+nB(g)![]() pC(g)+qQ(g) ��m��n��p��qΪ��������ʱ���ﵽƽ��ı�־��
pC(g)+qQ(g) ��m��n��p��qΪ��������ʱ���ﵽƽ��ı�־��
����ϵ��ѹǿ���ٸı�
����ϵ���¶Ȳ��ٸı�
������ֵ�Ũ�Ȳ��ٸı�
������ֵ������������ٸı�
����Ӧ����v(A):v(B):v(C):v(D) =m:n:p:q
����λʱ����m mol A�ϼ���Ӧ��ͬʱpmol CҲ�ϼ���Ӧ
A. �ۢܢݢ� B. �ڢۢܢ� C. �٢ۢܢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��0.3molNH3����������ԭ������_______��H2O����������ԭ������ȡ�
��2����һ�����¶Ⱥ�ѹǿ�£�1�������X2��3�������Y2�պû�������2�������A����A�Ļ� ѧʽ�ɱ�ʾΪ________��
��3����ͬ��ͬѹͬ����������£�H2������B������֮����1:8����B��Ħ������Ϊ________��
��4����25�桢101kPa�������£�ͬ������CH4������C�����֮����15:8����C��Ħ������Ϊ_______��
��5����ͬ�¶�����������ͬ�ݻ����ܱ����� D��E�У��ֱ������ͬ������X�����CO���壬D��E�е�ѹǿ֮����7:16����X��Ħ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾϸ���ڵ���ҪԪ�ؼ������������������������ǣ�������

A.S��P��������Ԫ��
B.ͼ����ʾΪ��Ԫ��ռϸ�����صı���
C.���ϸ����Ԫ�ش�����Ի��������ʽ����
D.OԪ�غ�����࣬����O�������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�
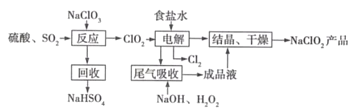
�ش��������⣺
��1��NaClO2��Cl�Ļ��ϼ�Ϊ_______��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ_______��
��3�������������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�Ϊ________��________�����������������Ӧ����Ҫ������______��
��4����β��������������������������ų�������ClO2�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________���÷�Ӧ������������_________��
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ____����������������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
�ۺ���������PFS����˭��������Ҫ������������ͼ���Ի��շ���мΪԭ���Ʊ�PFS��һ�ֹ������̡�

�ش���������
��1������м��ҪΪ���渽�д�������������������Ҫ�ɷ�Ϊ_________�������ɸ��Ŀ����_______
��2�����ʱ����ʵ�����_____��д���������ᷴӦ�����ӷ���ʽ_____________________��
��3����Ӧ���м�����������������_________������������������ʵ���____________�����ţ���
A��KMnO4 | B�� | C�� | D�� |
��4���ۺϸ�����Һ��pH���������һ���ķ�Χ�ڣ�pHƫСʱFe3+ˮ��̶�����pHƫ��ʱ��_______��
��5������ڳ�ѹ��������ѹ�������ŵ���______��
��6���λ���B�Ǻ�������������Ч������Ҫָ�꣬����ʽΪ![]() ��nΪ���ʵ�������Ϊ������Ʒ��Bֵ��ȡ��Ʒmg��ȷ����������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���Է�̪Ϊָʾ������c
��nΪ���ʵ�������Ϊ������Ʒ��Bֵ��ȡ��Ʒmg��ȷ����������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���Է�̪Ϊָʾ������c![]() �ı�NaOH��Һ�����к͵ζ������ֲ�����ȥ�����ų������Ӹ��ţ������յ�ʱ����NaOH��ҺV mL�����������������հ������飬����NaOH��Һ
�ı�NaOH��Һ�����к͵ζ������ֲ�����ȥ�����ų������Ӹ��ţ������յ�ʱ����NaOH��ҺV mL�����������������հ������飬����NaOH��Һ![]() ����֪����Ʒ��Fe����������w����B�ı���ʽΪ__________
����֪����Ʒ��Fe����������w����B�ı���ʽΪ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪KMnO4��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��2KMnO4+16HCl��Ũ����2MnCl2+8H2O+2KCl+5Cl2�����ش��������⣺
��1������˫���ű�ʾ���÷�Ӧת�Ƶ��ӵķ������Ŀ_______________________________
��2����������HClռHCl������_______ ����ԭ��Ԫ��_________����Ԫ�ط��ţ�
��3������״������0.5mol��������ʱ���÷�Ӧת�Ƶĵ�����Ϊ_____����NAΪ�����ӵ�������ֵ��
��4��15.8g KMnO4�뺬1.2molHCl��Ũ������ȫ��Ӧ������HCl�ӷ������ڷ�Ӧ�����Һ�м���������AgNO3��Һ��������_____g������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com