
【题目】E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是___。
(2)E、G、M三种元素的第一电离能由大到小的顺序为___(用元素符号表示),其原因为___。
(3)G的最简单氢化物的分子立体构型名称为___,M的最简单氢化物的分子中中心原子的杂化类型为___。M和Q的最简单氢化物的沸点大小顺序为___(写化学式)。
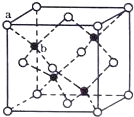
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm3。如果TQ的摩尔质量为Mg·mol1,阿伏加德罗常数为NAmol1,则a、b之间的距离为___cm。
【答案】3d104s2 N>O>C 同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于氧的 三角锥形 sp3 H2O>H2S 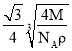
【解析】
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,M为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素,
(1)T为Zn元素,原子核外电子数为30,根据构造原理书写该原子价电子排布式;
(2)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于同周期相邻元素的第一电离能;
(3)氨气分子中N原子价层电子对数为4,孤电子对数为1,氨气分子为三角锥形;水分子中O原子价层电子对数为4,杂化轨道数目为4;水分子之间存在氢键,而硫化氢分子之间为范德华力,水的沸点较高;
(4)利用均摊法计算,一个该晶胞中黑色球个数是4、白色球个数=![]() ,晶胞质量为
,晶胞质量为![]() ,根据
,根据![]() 计算晶胞体积,再计算晶胞棱长,ab之间距离为该晶胞体对角线长的
计算晶胞体积,再计算晶胞棱长,ab之间距离为该晶胞体对角线长的![]() 。
。
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,M为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素,
(1)T为Zn元素,根据构造原理,该原子价电子排布式为3d104s2;
故答案为:3d104s2;
(2)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于氧的,故第一电离能:N>O>C;
故答案为:N>O>C;同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能大于氧的;
(3)氨气分子中N原子价层电子对数为4,孤电子对数为1,氨气分子为三角锥形;水分子中O原子价层电子对数为4,杂化轨道数目为4,则O原子采取sp3杂化;由于水分子之间存在氢键,而硫化氢分子之间为范德华力,则水的沸点较高;
故答案为:三角锥形;sp3;H2O>H2S;
(4)ZnS晶体结构如图所示,一个该晶胞中黑色球个数是4、白色球个数=![]() ,晶胞质量为
,晶胞质量为![]() ,晶胞的体积
,晶胞的体积![]() ,则晶胞棱长
,则晶胞棱长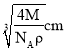 ,ab之间距离为该晶胞体对角线长的
,ab之间距离为该晶胞体对角线长的![]() ,则a、b之间的距离为
,则a、b之间的距离为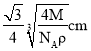 ;
;
故答案为: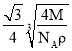 。
。


科目:高中化学 来源: 题型:
【题目】配平下列氧化还原反应方程式:
(1)______![]() ______HCl—______
______HCl—______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______H2O
______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O![]() 、K+、SO
、K+、SO![]()
B.c(Ca2+)=0.1molL-1的溶液中:NH![]() 、C2O
、C2O![]() 、Cl-、Br-
、Cl-、Br-
C.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO![]()
D.含大量HCO![]() 的溶液中:C6H5O-、CO
的溶液中:C6H5O-、CO![]() 、Br-、K+
、Br-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
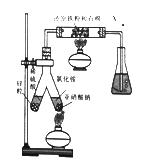
①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
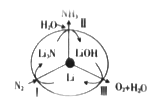
①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
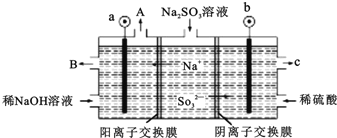
(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式___。
(2)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(3)SO32放电的电极反应式为___。
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___。
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 | B.平衡常数变大 | C.副反应增多 | D.反应活化能增大 |
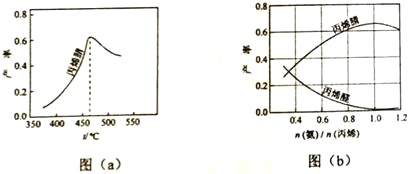
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)![]() H2(g)+I2(g);则下列有关说法正确的是
H2(g)+I2(g);则下列有关说法正确的是
A. 如改变体系温度,体系颜色不一定发生变化
B. 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C. 继续充入HI气体,达到平衡后, 体系颜色加深
D. 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A.简单离子的半径:X<Z<M
B.Y、R两种元素的气态氢化物稳定性:Y>R
C.最高价氧化物对应水化物的酸性:R<N
D.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com