
【题目】下列各组微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O![]() 、K+、SO
、K+、SO![]()
B.c(Ca2+)=0.1molL-1的溶液中:NH![]() 、C2O
、C2O![]() 、Cl-、Br-
、Cl-、Br-
C.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO![]()
D.含大量HCO![]() 的溶液中:C6H5O-、CO
的溶液中:C6H5O-、CO![]() 、Br-、K+
、Br-、K+
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:
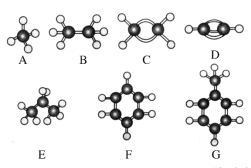
(1)常温下含碳量最高的气态烃是___(填对应字母);
(2)A分子的空间构型是___;
(3)G的一氯代物有___种;E的二氯代物有___种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式__,反应类型为___。
(5)写出F与浓硝酸和浓硫酸反应的化学方程式___,反应类型为___。
现有上面A、B、C三种有机化合物:(以下均用结构简式作答)
(6)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是___。
(7)等质量的以上三种物质燃烧时,生成二氧化碳最多的是___,生成水最多的是___。
(8)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
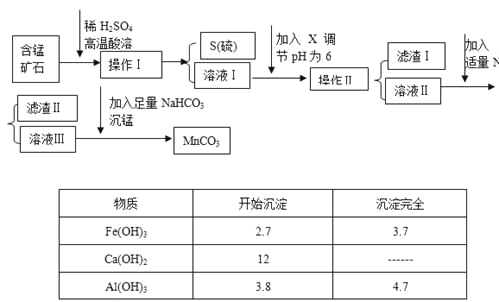
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中不正确的是( )
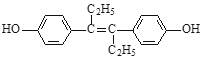
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚分子中一定有16个碳原子共平面
C. 己烯雌酚为芳香族化合物
D. 己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应![]() 在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
A.2、6、3、5B.3、1、2、2C.2、1、2、1D.1、3、2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色。
(1)该反应中氧化剂是 ______ ;
(2)该反应的还原产物是 ______ ;
(3)1 mol氧化剂在反应中得到电子的物质的量为 ______ ;
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并在氧化剂与还原剂之间标出电子转移的方向和数目。
_________NaBiO3+_____ ________ + _____ ________→_____ _______ + ______ ________+ ______ _______+ ______ _______。
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
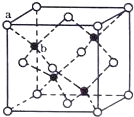
【题目】E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是___。
(2)E、G、M三种元素的第一电离能由大到小的顺序为___(用元素符号表示),其原因为___。
(3)G的最简单氢化物的分子立体构型名称为___,M的最简单氢化物的分子中中心原子的杂化类型为___。M和Q的最简单氢化物的沸点大小顺序为___(写化学式)。
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm3。如果TQ的摩尔质量为Mg·mol1,阿伏加德罗常数为NAmol1,则a、b之间的距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
A. 氢气的燃烧热为△H=-akJ·mol-1
B. c<d
C. 一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1
D. 0.5a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com