
【题目】一定条件下反应![]() 在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
A.2、6、3、5B.3、1、2、2C.2、1、2、1D.1、3、2、2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、现象和原理,正确的是
①吸滤操作可加快过滤速度,若吸滤完毕,则应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管;②往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2;③重结晶时,溶液冷却速度越慢得到的晶体颗粒越大;④可用水鉴别已烷、四氯化碳、乙醇三种无色液体;⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离;⑥加酶洗衣粉可用来洗涤棉织品、腈纶织品和涤纶织品;⑦硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物;⑧萃取时振荡的操作如图
![]()
A.②④⑧B.①③⑤C.③④⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中![]() 与
与![]() 互为等电子体. 1mol
互为等电子体. 1mol![]() 中含有的π键数目为 ______ .
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
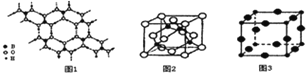
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示![]() 黑点代表铜原子,空心圆代表M原子
黑点代表铜原子,空心圆代表M原子![]() .
.
![]() 该晶体化学式为 ______ .
该晶体化学式为 ______ .
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ ![]() 填“离子”、“共价”
填“离子”、“共价”![]() 化合物.
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用![]() 表示)
表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在 20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性 KMnO4 溶液褪色,且有气泡产生。将酸性 KMnO4 溶液换成FeCl3 溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是

A. 20 ℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3 溶液时,产生的气体为Cl2
D. 该条件下H2 燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O![]() 、K+、SO
、K+、SO![]()
B.c(Ca2+)=0.1molL-1的溶液中:NH![]() 、C2O
、C2O![]() 、Cl-、Br-
、Cl-、Br-
C.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO![]()
D.含大量HCO![]() 的溶液中:C6H5O-、CO
的溶液中:C6H5O-、CO![]() 、Br-、K+
、Br-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
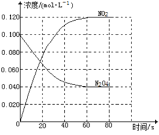
(1)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”“小于”),判断理由是___。
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
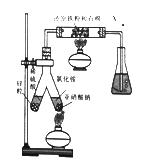
①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
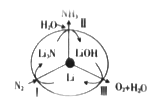
①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 | B.平衡常数变大 | C.副反应增多 | D.反应活化能增大 |
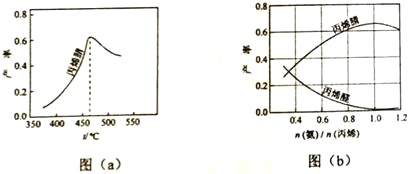
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素。它们在化学中占有极其重要的地位。
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为___________
②金属钠原子的堆积方式是体心立方,其配位数为___________
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈___________色的物质是水合铜离子,请写出它的结构简式,并标明其中配位键___________
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式___________
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有___________molσ键。
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:___________(要求:仅写1个总的离子方程式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com