
【题目】硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中![]() 与
与![]() 互为等电子体. 1mol
互为等电子体. 1mol![]() 中含有的π键数目为 ______ .
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
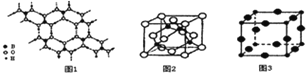
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示![]() 黑点代表铜原子,空心圆代表M原子
黑点代表铜原子,空心圆代表M原子![]() .
.
![]() 该晶体化学式为 ______ .
该晶体化学式为 ______ .
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ ![]() 填“离子”、“共价”
填“离子”、“共价”![]() 化合物.
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用![]() 表示)
表示)
【答案】1s22s22p63s23p63d10 2NA sp、sp2 N 3 正四面体型 CuCl 共价 ![]()
![]() 。
。
【解析】
根据基态离子核外电子排布规律写出离子的基态电子排布式;根据等电子原理判断离子结构;根据价层电子对互斥理论判断空间构型;根据电离能规律判断电离能大小;根据均摊法计算晶胞中粒子个数及晶胞密度。
(1)①Cu为29号元素,3d轨道有10个电子,4s轨道有1个电子,Cu原子失去最外层电子形成Cu+,Cu+的基态电子排布式为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
②等电子体的结构相似,则![]() 中含有三键,所以在1个
中含有三键,所以在1个![]() 含有2个π键,故1mol
含有2个π键,故1mol![]() 中,含有2NA个π键,故答案为:2NA;
中,含有2NA个π键,故答案为:2NA;
③丙烯腈(CH2=CHC=N)中的C分别形成2个σ键和3个σ键,故碳原子的杂化轨道类型为sp和sp2杂化;越易失去一个电子,则第一电离能越大,CH2=CHC=N中N元素最难失去电子,则N的第一电离能最大,故答案为:sp、sp2;N;
(2)一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1mol H3BO3分子的晶体中有3mol氢键,[B(OH)4]-中B原子形成4个共价键,则B原子的价层电子对数为4,为sp3杂化,没有孤电子对,空间结构为正四面体型,故答案为:3;正四面体型;
(3)M原子的外围电子排布式为3s23p5,M原子为Cl原子,则
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子位于顶点与面心上,晶胞中含有Cl原子数目为![]() ,故化学式为CuCl,故答案为:CuCl;
,故化学式为CuCl,故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键,故答案为:共价;
(4)该晶胞中大球个数![]() ,小球个数
,小球个数![]() ,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长
,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长![]() ,晶胞体积
,晶胞体积![]() ,晶胞密度
,晶胞密度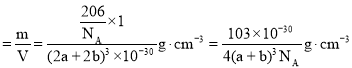 ,故答案为:6;
,故答案为:6;![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同价态氯(或卤素)的归中或歧化反应,试写出下列反应的离子方程式。
(1)次氯酸钠与盐酸反应:________________________。
(2)酸化NaIO3和NaI的混合溶液:_____________________。
(3)氯气通入热的氢氧化钾溶液(生成物中检测出含有氯酸钾):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )

A.三种离子对应的硫化物的溶度积常数中,Ksp(MnS)最大,约为1×10-15;Ksp(CuS)最小,约为1×10-35
B.MnS+Cu2+![]() CuS+Mn2+,K=1020
CuS+Mn2+,K=1020
C.向ZnS的悬浊液(含ZnS固体)中滴加少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)不变
D.向Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Cu2+最先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:
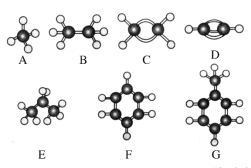
(1)常温下含碳量最高的气态烃是___(填对应字母);
(2)A分子的空间构型是___;
(3)G的一氯代物有___种;E的二氯代物有___种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式__,反应类型为___。
(5)写出F与浓硝酸和浓硫酸反应的化学方程式___,反应类型为___。
现有上面A、B、C三种有机化合物:(以下均用结构简式作答)
(6)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是___。
(7)等质量的以上三种物质燃烧时,生成二氧化碳最多的是___,生成水最多的是___。
(8)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______,尿素分子间的氢键可表示为______。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______![]() 填序号
填序号![]() 。
。
A.离子键B.金属键C.配位键D.σ键E.π键
③![]() 中N原子杂化后的价电子排布图为______,
中N原子杂化后的价电子排布图为______,![]() 的空间构型为______。
的空间构型为______。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
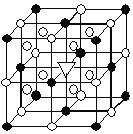
①Mg2NiH4中H的化合价为______。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______nm(用含d、M的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
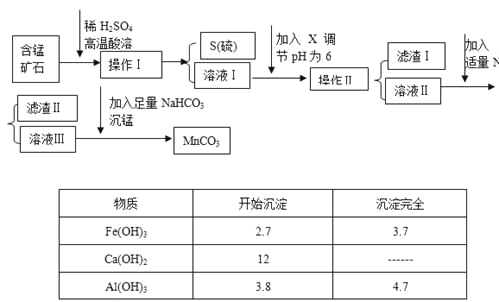
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应![]() 在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
A.2、6、3、5B.3、1、2、2C.2、1、2、1D.1、3、2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的块状的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断:______段化学反应速率最快,_______段收集的二氧化碳气体最多。
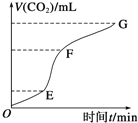
(2)上述反应中,A g块状碳酸钙跟足量盐酸反应,反应物消耗的质量随时间的变化曲线由实线表示,在相同的条件下,将B g(A>B)粉末状碳酸钙与足量的同浓度盐酸反应,反应物消耗的质量随时间的变化曲线由虚线表示。则最符合实际情况的图像是________。

(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_________。
A.蒸馏水 B.氯化钠 C.硝酸钾溶液 D.浓盐酸 E.降温 F加入MnO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com