
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
【答案】![]() 6 1 3
6 1 3 ![]() 2 1 1 2
2 1 1 2 ![]() 9 3 3 5
9 3 3 5
【解析】
(1)该反应中只有S元素化合价发生变化,先根据化合价升降总数相等配平S元素,再根据原子守恒配平未参加氧化还原反应的元素;
(2)该反应中只有Cl元素化合价发生变化,先根据化合价升降总数相等配平Cl元素,再根据原子守恒配平未参加氧化还原反应的元素;
(3)该反应中只有P元素化合价发生变化,先根据化合价升降总数相等配平P元素,再根据原子守恒配平未参加氧化还原反应的元素。
(1)该反应中只有S元素化合价发生变化,S既作氧化剂又作还原剂,S由0价生成-2价S和+4价S,化合价升降最小公倍数是4,所以反应产生Na2S的系数是2,生成Na2SO3的系数是1,反应消耗S单质系数是3,根据Na元素守恒,可知NaOH的系数是6,根据H元素守恒,可知H2O的系数是3,配平后的方程式为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O,方程式系数由前到后依次是3、6、1、3;
2Na2S+Na2SO3+3H2O,方程式系数由前到后依次是3、6、1、3;
(2)该反应中只有Cl元素化合价发生变化,Cl2既作氧化剂又作还原剂,Cl元素化合价由反应前Cl2中的0价生成CaCl2中的-1价和Ca(ClO)2中的+1价,化合价升降最小公倍数是2,所以反应物Cl2的系数是2,生成CaCl2、Ca(ClO)2的系数是1,根据Ca元素守恒,可知Ca(OH)2的系数是2,根据H元素守恒,可知H2O的系数是2,配平后的方程式为2Cl2+2Ca(OH)2![]() CaCl2+Ca(ClO)2+2H2O,方程式系数由前到后依次是2、2、1、1、2;
CaCl2+Ca(ClO)2+2H2O,方程式系数由前到后依次是2、2、1、1、2;
(3)该反应中只有P元素化合价发生变化,P4既作氧化剂又作还原剂,P元素化合价由0价生成-3价的PH3和+5价的H3PO4,化合价升降最小公倍数是15,所以反应产生K3PO4的系数是3,生成PH3的系数是5,反应消耗P4单质系数是2,根据K元素守恒,可知KOH的系数是9,根据H元素守恒,可知H2O的系数是3,配平后的方程式为:2 P4+9KOH+3H2O=3K3PO4+5PH3↑,方程式系数由前到后依次是2、9、3、3、5。


科目:高中化学 来源: 题型:
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②CO ③CO和H2的混合物 ④HCOOCH3⑤CH3CHO
A.⑤B.①②C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求回答下列有关烃类物质的问题现有A、B 两种烃,已知A的分子式为 C5Hm,而B的最简式为C5Hn(m、n 均为正整数).请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是_______(填序号).
a. 烃A和烃B可能互为同系物 b.烃A 和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃 d.当n=11时,烃B可能的分子式有 2 种
(2)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A 最多可与 1mol H2 加成,则A的名称是_____,该烃是否存在顺反异构_____(“是”或“否”)
(3)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加 1.26g, 再通过足量的碱石灰,碱石灰的质量增加 4.4g,则烃B的分子式为_____;若其苯环上的一溴代物只有一种, 则符合此条件的烃B有_________种,其中核磁共振氢谱中有4组峰,且峰面积之比为6:3:3:2 的有机物的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳素钢在海水中发生的腐蚀主要是析氢腐蚀
B.在铁制品表面镀锌时,铁制品与电源正极相连
C.NaHCO3溶液的水解方程式为:HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
D.已知室温时Ksp[Mg(OH)2]=5.6×10-12,室温下pH=8的Mg(OH)2悬浊液中c(Mg2+)=5.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉通过如图所示转化可以得到多种有机物:
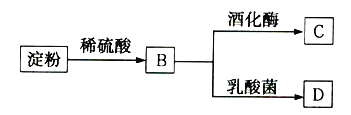
(1)检验淀粉是否完全水解,可以选用的试剂是__________(填序号)。
a.石蕊试液 b.淀粉碘化钾溶液 c.碘水
(2)B是一种单糖,则B的名称是____________________。
(3)B转化为C的化学方程式是______________________________。
(4)一分子B可在乳酸菌作用下分解生成两分子D,D与乙酸、乙醇均能发生酯化反应,且D的结构中含有甲基,则D的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M具有抗氧化、抗肿瘤作用,其结构简式如图所示。下列有关M的说法正确的是( )
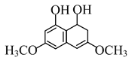
A.一定条件下M可发生加成、氧化、消去等反应
B.M与Na、NaOH溶液、NaHCO3溶液均能发生反应
C.1molM与浓溴水充分反应,最多消耗Br2的物质的量为4mol
D.M分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
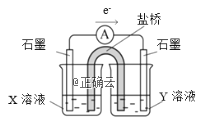
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5mL 0.5mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C-S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C-S-的电子式__________________________。
(2)用离子方程式表示FeSO4溶液显酸性的原因______________________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因___________。
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、现象和原理,正确的是
①吸滤操作可加快过滤速度,若吸滤完毕,则应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管;②往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2;③重结晶时,溶液冷却速度越慢得到的晶体颗粒越大;④可用水鉴别已烷、四氯化碳、乙醇三种无色液体;⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离;⑥加酶洗衣粉可用来洗涤棉织品、腈纶织品和涤纶织品;⑦硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物;⑧萃取时振荡的操作如图
![]()
A.②④⑧B.①③⑤C.③④⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中![]() 与
与![]() 互为等电子体. 1mol
互为等电子体. 1mol![]() 中含有的π键数目为 ______ .
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
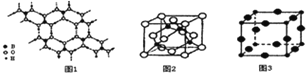
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示![]() 黑点代表铜原子,空心圆代表M原子
黑点代表铜原子,空心圆代表M原子![]() .
.
![]() 该晶体化学式为 ______ .
该晶体化学式为 ______ .
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ ![]() 填“离子”、“共价”
填“离子”、“共价”![]() 化合物.
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用![]() 表示)
表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com