
【题目】按照要求回答下列有关烃类物质的问题现有A、B 两种烃,已知A的分子式为 C5Hm,而B的最简式为C5Hn(m、n 均为正整数).请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是_______(填序号).
a. 烃A和烃B可能互为同系物 b.烃A 和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃 d.当n=11时,烃B可能的分子式有 2 种
(2)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A 最多可与 1mol H2 加成,则A的名称是_____,该烃是否存在顺反异构_____(“是”或“否”)
(3)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加 1.26g, 再通过足量的碱石灰,碱石灰的质量增加 4.4g,则烃B的分子式为_____;若其苯环上的一溴代物只有一种, 则符合此条件的烃B有_________种,其中核磁共振氢谱中有4组峰,且峰面积之比为6:3:3:2 的有机物的结构简式为______。
【答案】d; 2-甲基-2-丁烯; 否; C10H14; 4; 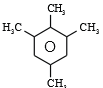 ;
;
【解析】
若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A 最多可与 1mol H2 加成,根据加成的量,可分析A为单烯烃,再分析共面双键的位置,得到结构为: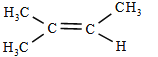 ,浓硫酸的质量增加 1.26g,即为水的质量,
,浓硫酸的质量增加 1.26g,即为水的质量,![]() ,碱石灰的质量增加 4.4g,即为二氧化碳的质量,
,碱石灰的质量增加 4.4g,即为二氧化碳的质量, ![]() ,则B的最简式为C5H7,在根据苯的同系物的通式为:CnH2n-6,则B的分子式为C10H14。
,则B的最简式为C5H7,在根据苯的同系物的通式为:CnH2n-6,则B的分子式为C10H14。
(1)a.若为A的分子式为 C5H10 ,B的分子式为C10H20,且均为烯烃,则可互为同系物,故a正确;
b.若m=n 时,A和B分子式相同,互为同分异构体,故b正确;
c.当 m=12 时,烃A的分子式C5H10,为饱和烃,一定为烷烃,故c正确;
d.当 n=11 时,烃B可能的分子式只能是C10H22,只有一种,故d不正确。
答案为:d;
(2)若烃 A 为链烃,且分子中所有碳原子一定共面,分子中所有碳在一个平面上,且1mol A 最多可与 1mol H2 加成,则A为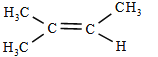 ,名称为:2-甲基-2-丁烯,在结构中,双键碳上连接有相同原子团,故不存在顺反异构,故答案为:2-甲基-2-丁烯;否;
,名称为:2-甲基-2-丁烯,在结构中,双键碳上连接有相同原子团,故不存在顺反异构,故答案为:2-甲基-2-丁烯;否;
(3)浓硫酸的质量增加 1.26g,即为水的质量,![]() ,碱石灰的质量增加 4.4g,即为二氧化碳的质量,
,碱石灰的质量增加 4.4g,即为二氧化碳的质量, ![]() ,则B的最简式为C5H7,在根据苯的同系物的通式为:CnH2n-6,则B的分子式为C10H14,其苯环上的一溴代物只有一种,则符合条件的结构为:
,则B的最简式为C5H7,在根据苯的同系物的通式为:CnH2n-6,则B的分子式为C10H14,其苯环上的一溴代物只有一种,则符合条件的结构为:
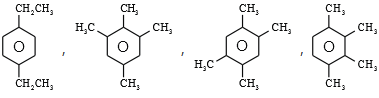 ,其中核磁共振氢谱中有 4 组峰,且峰面积之比为 6:3:3:2 的有机物的结构简式为
,其中核磁共振氢谱中有 4 组峰,且峰面积之比为 6:3:3:2 的有机物的结构简式为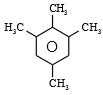 ,故答案为:4;
,故答案为:4; 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol。试回答:
(1)烃A的分子式为______。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______。
(3)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有______g烃A参加了反应,燃烧时消耗标准状况下的氧气______L。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式有(不考虑立体异构)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验室制取乙炔、洗气和性质实验所需的装置及试剂,按要求回答下列问题:
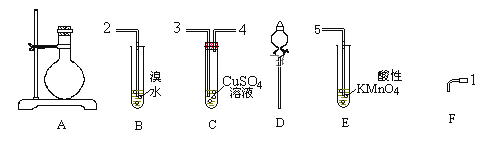
1)请选出制取乙炔气体所需的装置________(填字母,选错扣分)
2)如果将产生的气体按照发生、洗气、性质实验装置的顺序从左到右连接起来,请写出接口连接的数字顺序:发生装置出口____ 接 ____ 接____ 接_____ 或_____。(填数字)
3)写出制取乙炔的化学方程式:____________________________________________ 。
4)装置C的作用 是________________________________________________________ 。
5)如果要进行乙炔的可燃性实验,首先应该__________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应![]() 的能量变化如图所示:
的能量变化如图所示:
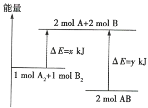
(1)2mol AB的总能量___________________(填“高于”或“低于”)1mol A2和1mol B2的总能量,该反应为___________(填“吸收”或“释放”)能量的反应。
(2)断裂2mol A2和2mol B2的化学键需吸收______kJ能量,断裂1.5mol AB的化学键需吸收_____kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为______;铝的化合物明矾可用于净水,其原理用离子方程式解释为___________。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是________。
②步骤II中涉及铝元素的离子方程式为______;
③步骤III中能否用HCl代替CO2?_____(填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为_______;向该滤液中滴加少量NaOH溶液,则![]() ____填(“变大”、“变小”或“不变”)
____填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是![]()
A.60g丙醇中存在的共价键总数为10NA
B.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3 NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数为3.75 NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数为3.75 NA
D.235g核素![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子 (
,净产生的中子 (![]() )数为14 NA
)数为14 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同价态氯(或卤素)的归中或歧化反应,试写出下列反应的离子方程式。
(1)次氯酸钠与盐酸反应:________________________。
(2)酸化NaIO3和NaI的混合溶液:_____________________。
(3)氯气通入热的氢氧化钾溶液(生成物中检测出含有氯酸钾):_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com