
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5mL 0.5mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C-S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C-S-的电子式__________________________。
(2)用离子方程式表示FeSO4溶液显酸性的原因______________________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因___________。
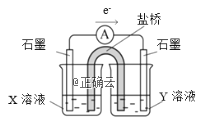
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________________。
【答案】![]() Fe2++2H2O
Fe2++2H2O![]() Fe(OH)2+2H+ MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O Fe3++3SCN-
Fe(OH)2+2H+ MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O Fe3++3SCN-![]() Fe(SCN)3 0.1mol/L KSCN溶液,硫酸酸化的KMnO4溶液 一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀
Fe(SCN)3 0.1mol/L KSCN溶液,硫酸酸化的KMnO4溶液 一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀
【解析】
(1)根据结构式即可写电子式;
(2)考查盐类水解;
(3)探究溶液变红后褪色原因,先变红是Fe2+氧化为Fe3+,Fe3+再与 SCN-结合生成Fe(SCN)3;后褪色设计成原电池,从电子转移方向可判断正负极,结合化合价改变可判断电解质溶液。
(1)根据结构式N≡C-S-,可知电子式为![]() ;
;
(2)FeSO4是强酸弱碱盐,显酸性的原因是Fe2+的水解,离子方程式为:Fe2++2H2O![]() Fe(OH)2+2H+,
Fe(OH)2+2H+,
(3)①KMnO4将Fe2+氧化为Fe3+,Fe3+再与SCN-结合生成Fe(SCN)3,溶液变红,离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,Fe3+ +3SCN-![]() Fe(SCN)3;
Fe(SCN)3;
②探究SCN-是否被酸性KMnO4氧化为SO42-,设计成原电池,由电子转移方向可知, X溶液所处电极为负极,化合价升高,失去电子,故X溶液是0.1mol/L KSCN溶液,Y溶液是硫酸酸化的KMnO4溶液;检验产物SO42-的操作及现象是:一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀。


科目:高中化学 来源: 题型:
【题目】下列是实验室制取乙炔、洗气和性质实验所需的装置及试剂,按要求回答下列问题:
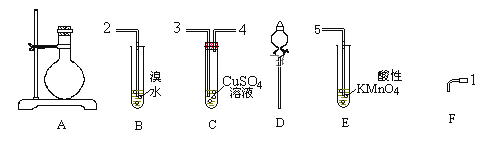
1)请选出制取乙炔气体所需的装置________(填字母,选错扣分)
2)如果将产生的气体按照发生、洗气、性质实验装置的顺序从左到右连接起来,请写出接口连接的数字顺序:发生装置出口____ 接 ____ 接____ 接_____ 或_____。(填数字)
3)写出制取乙炔的化学方程式:____________________________________________ 。
4)装置C的作用 是________________________________________________________ 。
5)如果要进行乙炔的可燃性实验,首先应该__________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量。查阅资料得知:
一种常用的分析试剂 EDTA二钠盐(用Na2H2Y2H2O表示)可用于测定Ca2+,其反应为:
Ca2++H2Y2-=CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色。于是该实验小组做了如下实验:
步骤一:配制待测溶液。取适量补钙片研碎后,准确称取0.400g配成250mL溶液。
步骤二:滴定。用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇
匀,再加入铬黑T指示剂3滴,用0.0100molL1EDTA二钠盐溶液滴定至终点。三次重复滴定平均消耗EDTA二钠盐溶液22.50mL。
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为__________________,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____→____(填下列操作的序号)。
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为_______。
(3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同价态氯(或卤素)的归中或歧化反应,试写出下列反应的离子方程式。
(1)次氯酸钠与盐酸反应:________________________。
(2)酸化NaIO3和NaI的混合溶液:_____________________。
(3)氯气通入热的氢氧化钾溶液(生成物中检测出含有氯酸钾):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
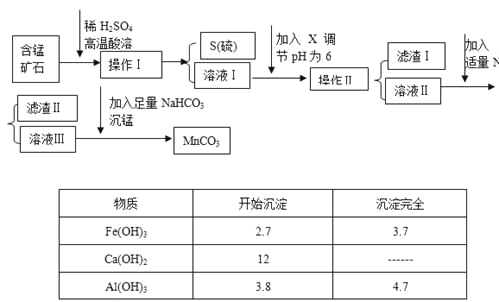
回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com