
【题目】地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素。它们在化学中占有极其重要的地位。
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为___________
②金属钠原子的堆积方式是体心立方,其配位数为___________
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈___________色的物质是水合铜离子,请写出它的结构简式,并标明其中配位键___________
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式___________
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有___________molσ键。
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:___________(要求:仅写1个总的离子方程式)
【答案】Mg>Al>Na 8 天蓝 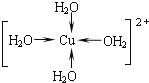 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 16 6Na2O2+6H2O+4Fe3+=4Fe(OH)3↓+12Na++3O2↑
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 16 6Na2O2+6H2O+4Fe3+=4Fe(OH)3↓+12Na++3O2↑
【解析】
(1)①Na、Mg、Al同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素;
②钠为体心立方堆积,钠晶胞中每个钠离子的配位数为8;
(2)①铜离子与水络合生成水合铜离子显蓝色,铜离子提供4个空轨道;
②依据离子反应方程式书写规则书写即可;
③依据结构式计算含有的共价键数;
(3)过氧化钠先与水反应生成氢氧化钠与氧气,氢氧化钠与铁离子生成氢氧化铁红褐色沉淀。
(1)①Na、Mg、Al同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能Mg>Al>Na;
②钠为体心立方堆积,故钠晶胞中每个钠离子的配位数为8;
(2)①硫酸铜溶液中因为存在水合铜离子而使得溶液呈天蓝色,水合铜离子为:[Cu(H2O)4]2+,其中Cu2+与4个H2O中的氧原子形成配位键,其结构式为: ;
;
②氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;
③深蓝色溶液中的阳离子为四氨合铜络离子:[Cu(NH3)4]2+,1mol[Cu(NH3)4]2+中存在4+12=16molσ键;
(3)过氧化钠与水反应生成氢氧化钠和氧气,其中氢氧化钠与铁离子又生成氢氧化铁沉淀,故离子反应方程式为:6Na2O2+6H2O+4Fe3+=4Fe(OH)3↓+12Na++3O2↑。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下反应![]() 在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
A.2、6、3、5B.3、1、2、2C.2、1、2、1D.1、3、2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的块状的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断:______段化学反应速率最快,_______段收集的二氧化碳气体最多。
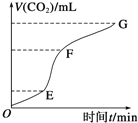
(2)上述反应中,A g块状碳酸钙跟足量盐酸反应,反应物消耗的质量随时间的变化曲线由实线表示,在相同的条件下,将B g(A>B)粉末状碳酸钙与足量的同浓度盐酸反应,反应物消耗的质量随时间的变化曲线由虚线表示。则最符合实际情况的图像是________。

(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_________。
A.蒸馏水 B.氯化钠 C.硝酸钾溶液 D.浓盐酸 E.降温 F加入MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5,表示,咸水中的主要溶质为NaCl。下列有关说法正确的是

A. a为原电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式为![]()
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
A. 氢气的燃烧热为△H=-akJ·mol-1
B. c<d
C. 一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1
D. 0.5a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是

A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究反应![]() 的能量变化情况,某同学设计了如图所示实验装置。当向盛有固体A(A不与水反应)的试管中滴加溶液B时,发现U形管中甲处液面下降,乙处液面上升。试回答下列问题。
的能量变化情况,某同学设计了如图所示实验装置。当向盛有固体A(A不与水反应)的试管中滴加溶液B时,发现U形管中甲处液面下降,乙处液面上升。试回答下列问题。
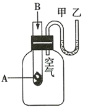
(1)所发生的反应________(填“放出”或“吸收”)热量。
(2)参加反应的A和B的总能量________(填“高于”或“低于”)生成的C和D的总能量。
(3)该反应中物质的化学能通过化学反应转化成________释放出来。
(4)该反应中,断裂反应物中化学键吸收的能量________(填“高于”或“低于”)形成生成物中化学键放出的能量。
(5)写出一个符合题中条件的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)2C(g)△H=﹣a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
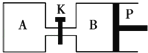
A.500℃达平衡时有:c1>c2
B.500℃达平衡时有:a>b>c
C.达平衡后打开K,容器B的体积将减小
D.此反应的平衡常数随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com