
下列实验能达到预期目的的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别SO42-与SO32-
⑤用溴水检验汽油中是否含有不饱和烃
A.①②③ B.①③④ C.②③⑤ D.②④⑤
科目:高中化学 来源:2014年化学高考总复习课时演练 11-1化学实验仪器和基本操作练习卷(解析版) 题型:选择题
下列实验操作中,仪器需插入液面以下的有( )
①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;
②制备氢气,简易装置中长颈漏斗的下端管口;
③分馏石油时,测量温度所用的温度计;
④将氯气溶于水时输送氯气的导气管;
⑤用水吸收氨气时的导气管;
⑥用胶头滴管向试管中的BaCl2溶液中滴加稀硫酸
A.①②④ B.①③⑤
C.③⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第四章非金属及其化合物练习卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl-
B.亚硫酸氢铵和氢氧化钠的反应: +OH-
+OH-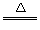 NH3↑+H2O
NH3↑+H2O
C.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.Ca(HCO3)2溶液与少量NaOH溶液反应:
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:实验题
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。

(1)步骤1所需玻璃仪器是______;步骤3的操作名称是______。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠;
假设2:只含有___________;
假设3:氯化钠和氢氧化钠都含有。
(3)设计实验方案,进行实验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是______。
②填写下表:
实验步骤 | 预期现象和结论 |
步骤4: |
|
步骤5: |
|
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列装置或操作不能达到实验目的的是( )


A.利用甲装置检查装置的气密性
B.利用乙装置制取NO2,并检验其还原性,小试管中的试剂可为淀粉KI溶液
C.利用丙装置制取并收集氨气
D.利用丁装置分离沸点相差较大的液体混合物
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列关于实验安全的叙述中错误的是( )
A.使用、制备有毒气体应在通风橱中进行,应有完全吸收处理装置
B.酒精及其他易燃物小面积失火,应该迅速使用湿抹布盖灭;钠、钾等失火应用泡沫灭火器扑灭
C.汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇
D.学生实验时应戴防护眼镜,万一眼睛中溅进酸或碱溶液,应立即用水冲洗(切忌用手揉眼睛),然后请医生处理
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第六、七章化学反应与能量速率平衡卷(解析版) 题型:选择题
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
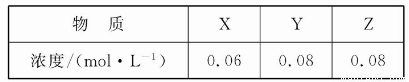
下列说法正确的是( )
A.此时v(正)<v(逆)
B.平衡时Y的浓度为0.05 mol·L-1
C.平衡时X的转化率为40%
D.增大压强使平衡向正反应方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第八章水溶液中的离子平衡练习卷(解析版) 题型:填空题
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1

表2

请回答下面问题:
(1)CH3COONH4的水溶液呈 (选填“酸性”、“中性”或“碱性”),理由是 。溶液中各离子浓度大小关系是 。
(2)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第二章化学物质及其变化练习卷(解析版) 题型:填空题
1 L 某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、 |
可能大量含有的阴离子 | Cl-、Br-、I-、 |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是________________。

(2)BC段的离子方程式为__________________________。
(3)V1、V2与V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为____________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com