
下列反应的离子方程式正确的是( )
A.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl-
B.亚硫酸氢铵和氢氧化钠的反应: +OH-
+OH-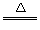 NH3↑+H2O
NH3↑+H2O
C.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.Ca(HCO3)2溶液与少量NaOH溶液反应:
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年化学高考总复习课时演练 11-3物质的制备练习卷(解析版) 题型:实验题
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。

试回答:(1)该实验中A部分的装置是____(填写装置的序号)。

(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):____________________________。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式
__________________。
(4)该实验存在明显的缺陷,请你提出改进的方法___________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g ,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为: 2Na2S2O3+I2=Na2S4O6 + 2NaI 反应完成时,共用去Na2S2O3
20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为:_____________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 1-2物质的量在实验中的应用练习卷(解析版) 题型:选择题
如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )
硫酸 化学纯(CP)(500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 1-1物质的量 气体摩尔体积练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数。下列叙述正确的是( )
A.28 g CO与N2的混合气体所占的体积约是22.4 L
B.已知2SO2(g)+O2(g) 2SO3(g) ΔH=-a kJ·mol-1,若将2NA个SO2与NA个O2混合充分反应放出a kJ的热量
2SO3(g) ΔH=-a kJ·mol-1,若将2NA个SO2与NA个O2混合充分反应放出a kJ的热量
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第四章非金属及其化合物练习卷(解析版) 题型:填空题
如图中的所有物质均由短周期元素组成。其中甲、乙、丙、丁为单质,常温下甲、乙为无色气体,丁为黄绿色气体。丙是常见金属,广泛用于航天、航空工业。工业上从海水中提取G后再通过电解G制取丙,同时得到副产物丁。A、E的分子中均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体,E在常温下是无色无味的溶液。框图中各物质转化所涉及的条件均已省略。回答下列问题:

(1)反应①~⑤中属于氧化还原反应的是_________(填序号)。
(2)画出丙的原子结构示意图_________,写出A的电子式_________,写出A、B的等电子体(原子数和电子数均相等的粒子) _________、_________ (用化学式表示)。
(3)C的水溶液显酸性,用离子方程式解释_______________________________
_______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第四章非金属及其化合物练习卷(解析版) 题型:选择题
一定温度下,将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )

A.将饱和氯水升温,继续通入Cl2时,溶液中c(H+)变化如曲线b
B.在饱和氯水中通入SO2气体,溶液中c(H+)变化如曲线c
C.降温,继续通入Cl2时,溶液中c(H+)的变化曲线如b
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在c(Na+)>c(ClO-)>c(Cl-)
>c(HClO)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第四章非金属及其化合物练习卷(解析版) 题型:选择题
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如图)。下列说法
正确的是( )

A.SiO2属于两性氧化物
B.盛放Na2CO3溶液的试剂瓶不能用玻璃塞
C.硅胶吸水后不能重复再利用
D.图中所示的转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列实验能达到预期目的的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别SO42-与SO32-
⑤用溴水检验汽油中是否含有不饱和烃
A.①②③ B.①③④ C.②③⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第八章水溶液中的离子平衡练习卷(解析版) 题型:选择题
常温下,pH=12的氨水中存在以下电离平衡:
NH3·H2O NH4+ +OH- 。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是( )
NH4+ +OH- 。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是( )
A. c(NH4+) B. c(OH-) C. c(NH3·H2O) D.c(NH4+)·c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com