
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
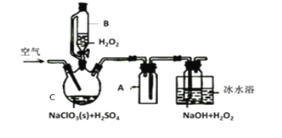
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
【答案】降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解 空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解率降低 2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O 当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 90.5%
【解析】
氯酸钠在酸性条件下与过氧化氢生成二氧化氯,二氧化氯与氢氧化钠容易和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随着温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,据此分析(1)-(3)问。(4)根据碘遇淀粉变蓝色,Na2S2O3标准液消耗碘单质,根据颜色变化说明滴定终点;根据电子转移数守恒结合关系式NaClO2~2I2~4S2O32-进行求解。
(1)冰水浴冷却的目的是降低NaClO2的溶解度,低温可以减少H2O2的分解;ClO2熔点-59℃、沸点11℃,所以低温可以增加ClO2的溶解度,减少ClO2的分解,故答案为:降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解;
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高ClO2易分解,最终导致NaClO2产率降低,故答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高ClO2易分解,最终导致NaClO2产率降低;
(3)氯离子存在是会催化二氧化氯的生成,反应开始时在三颈烧瓶中加入少量盐酸,二氧化氯的生成速率大大提高,并产生微量的氯气,方程式为2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,因此当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复,说明到达滴定终点;因溶液中n(S2O32-)=2molL-1×0.02L×![]() =0.4mol,令样品中NaClO2的质量分数为x,则:
=0.4mol,令样品中NaClO2的质量分数为x,则:
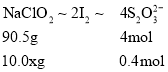
所以90.5g:10.0 xg=4mol:0.4mol,解得x=90.5%,故答案为:当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复;90.5%。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
B.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.Al![]() NaAlO2
NaAlO2![]() AlCl3溶液
AlCl3溶液![]() 无水AlCl3
无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料。结合以下路线回答下列问题。
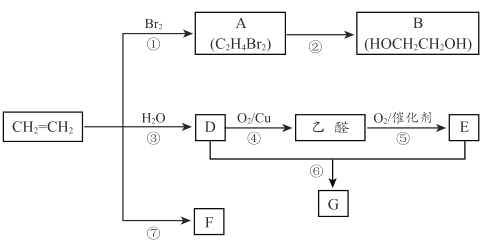
(1)反应①的化学方程式是 ____________________。
(2)B的官能团是_______________。
(3)反应④的化学方程式是_________________。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F 的结构简式是__________。
(5)E的分子式是 C2H4O2能使紫色石蕊试液变红; G 是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取 G, 装置如图所示。
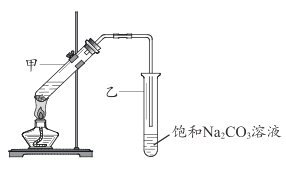
i.甲试管中反应的化学方程式是 __________;反应类型是_________。
ii.分离出试管乙中油状液体用到的主要仪器是___________________。
iii.如果将 4. 6g D 和 3g E 在催化剂条件下发生上述反应 ,充分反应后,如果实际产率为60%,实际得到G 的质量是__________ g。(已知:实际产率= 实际得到质量/理论计算质量)
(6)丙烯( CH3CH = CH2 ) 与乙烯互为同系物,在催化剂、加热条件下与O2 反应生成一种重要的化工原料丙烯酸( CH2= CHCOOH )。下列关于丙烯酸的说法正确的是 ________。
a.与乙酸互为同系物
b.能发生加成、酯化、氧化反应
c.能与 NaHCO3溶液反应生成 CO2
d.一定条件下能发生加聚反应,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )

A.气态氢化物稳定性:R>Q
B.元素T的离子半径>元素R的离子半径
C.与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键
D.Q可形成多种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
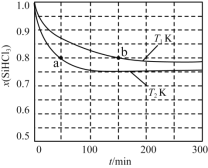
A. 该反应为放热反应,v正,a<v逆,b
B. 化学平衡状态时2v消耗(SiHCl3)=v消耗(SiCl4)
C. 当反应进行到a处时,v正/v逆=16/9
D. T2 K时平衡体系中再充入1 mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X阴离子的电子数与Y原子的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素名称为___________;五种元素的原子半径从小到大的顺序是(用元素符号表示)______________。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,用电子式表示A的形成过程_______________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________。
(4)一定条件下,M与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
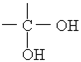 →
→![]() +H2O
+H2O
如图是9个化合物的转变关系:
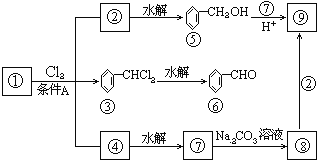
(1)化合物①的结构简式为_______,它跟氯气发生反应的条件A是_______。⑦的结构式为________。
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨,⑨的结构简式是________。
(3)写出③→⑥的化学方程式________。
(4)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它。此反应类型为_____。反应的化学方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com