
【题目】人体的血液的pH需控制在7.35~7.45之间,过高过低都会引起身体不适,甚至危及生命。人体血液能维持在稳定的pH范围主要是人血浆中一定浓度的![]() 和
和![]() 起调节作用。按要求回答下列问题。
起调节作用。按要求回答下列问题。
(1)用离子方程式解释血液呈弱碱性的原因____;
(2)当血液的![]() (即
(即![]() 浓度为
浓度为![]() )时,
)时,![]() 和
和![]() 浓度比值约为20:1,计算此时碳酸的
浓度比值约为20:1,计算此时碳酸的![]() ___;查阅资料得常温下碳酸的
___;查阅资料得常温下碳酸的![]() ,解释与计算所得数据存在差异的原因____。
,解释与计算所得数据存在差异的原因____。
科目:高中化学 来源: 题型:
【题目】四氢大麻酚具有抗癌、抗菌等作用,其结构简式如图所示。下列说法不正确的是( )
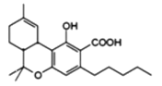
A.每个四氢大麻酚分子中含有2个手性碳原子
B.四氢大麻酚能与FeCl3溶液发生显色反应
C.1mol四氢大麻酚最多可与1molBr2发生反应
D.1mol四氢大麻酚与NaOH溶液反应,最多消耗2 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
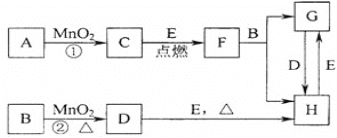
(1)写出有关物质的名称或化学式:F______,H_____。
(2)若反应①是在加热条件下进行,则A是___;若反应①是在常温条件下进行,则A是___。
(3)写出B与MnO2共热获得D的化学方程式______。
(4)写出D与E共热获得H的化学方程式________。
(5)如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:2min内,A物质的平均反应速率为______。
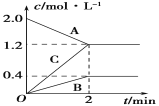
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )
![]()
A. 若甲是AlCl3溶液,则丁可能是NaOH溶液
B. 若甲是Fe,则丁可能是Cl2
C. 若丁是CO2,则甲可能为Mg
D. 若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种半水煤气中主要含![]() 、CO、
、CO、![]() 、
、![]() 和少量
和少量![]() ,经“脱硫”、转换反应可制得合成氨原料气。
,经“脱硫”、转换反应可制得合成氨原料气。
(1)这种半水煤气跟空气按一定比例混合后通入![]() 、
、![]() 的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为
的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为![]() ,该转化过程中起催化作用的离子为____,写出该过程中属于非氧化还原反应的离子方程式___。
,该转化过程中起催化作用的离子为____,写出该过程中属于非氧化还原反应的离子方程式___。
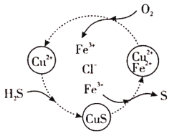
(2)脱硫后的半水煤气与水蒸气以1:15比例混合后通入转换塔中,变换反应为:![]() 。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
第一步:![]()
![]() (慢反应)
(慢反应)
第二步:![]()
![]() (快反应)
(快反应)
①在下图中绘制变换反应(经上述催化反应过程)的“能量~反应过程”示意图___。
②由于![]() 和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是____。
和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是____。
(3)半水煤气处理后得到的混合气中,可通过在熔融碳酸盐中经电化学还原消除其中的二氧化碳,并得到高纯度的碳,写出生成碳的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为元素周期表中原子序数依次增大的三种短周期元素,Y与X、Z均相邻,X、Y与Z三种元素原子的最外层电子数之和为19;W的单质为生活中一种常见的金属,在Z元素的单质中燃烧产生棕黄色的烟,生成![]() 。回答下列问题:
。回答下列问题:
(1)Z元素在元素周期表中的第____周期。
(2)![]() 与足量的
与足量的![]() 的水溶液发生反应生成两种强酸,写出该反应的离子方程式____。
的水溶液发生反应生成两种强酸,写出该反应的离子方程式____。
(3)![]() 易升华,易溶于水,乙醇/丙酮等溶剂。据此推测其晶体熔化时克服的作用力是__,判断的依据是____。
易升华,易溶于水,乙醇/丙酮等溶剂。据此推测其晶体熔化时克服的作用力是__,判断的依据是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断错误的是( )
A.在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-
B.在含等物质的量的CO32-、HCO3-的溶液中,逐滴加入盐酸:CO32-、HCO3-
C.在含等物质的量的K2CO3、KOH的溶液中,缓通入CO2:KOH、K2CO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.28g N2含有的原子数为NA
B.1mol Zn与足量盐酸反应失去的电子数为2NA
C.标准状况下22.4L水中含有的H2O分子数为NA
D.2mol /L NaCl溶液中含有Na+个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com