
【题目】四氢大麻酚具有抗癌、抗菌等作用,其结构简式如图所示。下列说法不正确的是( )
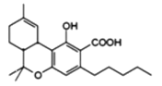
A.每个四氢大麻酚分子中含有2个手性碳原子
B.四氢大麻酚能与FeCl3溶液发生显色反应
C.1mol四氢大麻酚最多可与1molBr2发生反应
D.1mol四氢大麻酚与NaOH溶液反应,最多消耗2 molNaOH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g)![]() CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)![]() CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
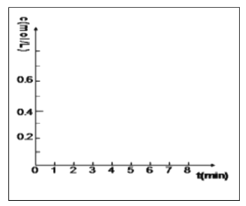
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
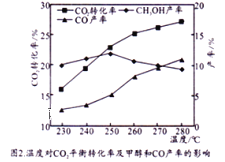
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
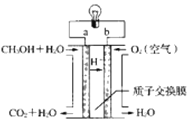
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮物质等被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是最重要的化工产品之一。
(一)发射卫星时可用N2H4为燃料,若用氟作氧化剂,已知:
![]()
![]()
![]()
![]()
![]()
![]()
则N2H4与F2反应的热化学方程式为:________。
(二)汽车尾气净化反应:![]() △H
△H
(1)该反应的逆反应速率随时间变化的关系如图:
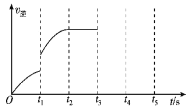
反应在t2时达平衡,在t1时改变了某种条件,改变的条件不可能是________。
A. 升温 B. 加压
C. 使用催化剂 D. 增大NO的浓度
(2)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率及CO2的体积分数变化图如下:
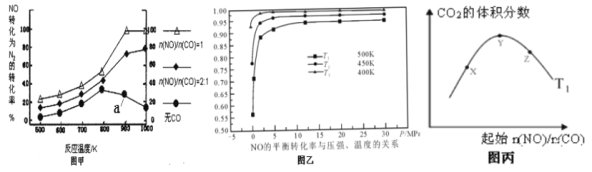
下列说法正确的是________。
A. 由图乙可得△H<0,反应低温自发
B. 为达到NO转化为N2的最佳转化率,应该选择的温度为900K,n(NO)/n(CO)=1
C. 图甲中对应的a点一定处于平衡状态
D. 图丙中X、Y、Z三点,CO的转化率由大到小的关系为Z>Y>X
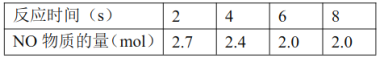
(3)向初始体积为4.5L的密闭容器中通入3molNO、1.5molCO,在恒压条件下发生反应:![]() ,平衡体系中NO的物质的量变化见下表。此温度下,该反应的平衡常数K=________。
,平衡体系中NO的物质的量变化见下表。此温度下,该反应的平衡常数K=________。
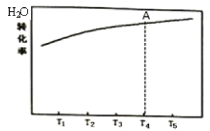
(三)尿素被广泛用作氮肥。
(1)在恒容的密闭容器中,发生反应![]() 。测得H2O的平衡转化率随温度的变化关系如图所示,已知T4时达平衡所需时间为t。请在图中画出反应经相同时间t时,H2O的转化率随温度变化的曲线。______________
。测得H2O的平衡转化率随温度的变化关系如图所示,已知T4时达平衡所需时间为t。请在图中画出反应经相同时间t时,H2O的转化率随温度变化的曲线。______________
(2)工业上可通过电解的方法处理尿素![]() 的碱性溶液,产物中无污染物,试写出电解时阳极的电极反应式________。
的碱性溶液,产物中无污染物,试写出电解时阳极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为___。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___;氮元素的E1呈现异常的原因是___。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为___,不同之处为____。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____、____。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是( )
A.石油液化气、汽油和石蜡的主要成分都是碳氢化合物
B.1,2-二氯乙烷在NaOH醇溶液中发生消去反应可以得到乙炔
C.由CH2=CHCOOCH3合成的聚合物为![]()
D.能与NaOH溶液反应且分子式为C2H4O2的有机物一定是羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个化学反应过程,图中的黑球表示两个相同的单糖或其单元。
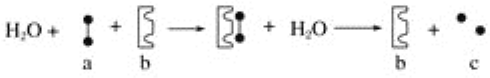
则图中的a、b、c分别表示( )
A. 麦芽糖 麦芽糖酶 葡萄糖
B. 蔗糖 蔗糖酶 果糖
C. 乳糖 乳糖酶 葡萄糖
D. 淀粉 淀粉酶 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得:

有关上述反应物和产物的叙述不正确的是
A.上述三种有机物中共有四种含氧官能团
B.贝诺酯分子中有9种不同化学环境的氢原子
C.1mol贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol
D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的血液的pH需控制在7.35~7.45之间,过高过低都会引起身体不适,甚至危及生命。人体血液能维持在稳定的pH范围主要是人血浆中一定浓度的![]() 和
和![]() 起调节作用。按要求回答下列问题。
起调节作用。按要求回答下列问题。
(1)用离子方程式解释血液呈弱碱性的原因____;
(2)当血液的![]() (即
(即![]() 浓度为
浓度为![]() )时,
)时,![]() 和
和![]() 浓度比值约为20:1,计算此时碳酸的
浓度比值约为20:1,计算此时碳酸的![]() ___;查阅资料得常温下碳酸的
___;查阅资料得常温下碳酸的![]() ,解释与计算所得数据存在差异的原因____。
,解释与计算所得数据存在差异的原因____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com