
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
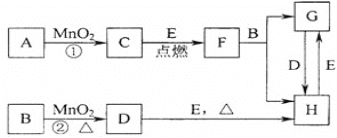
(1)写出有关物质的名称或化学式:F______,H_____。
(2)若反应①是在加热条件下进行,则A是___;若反应①是在常温条件下进行,则A是___。
(3)写出B与MnO2共热获得D的化学方程式______。
(4)写出D与E共热获得H的化学方程式________。
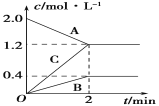
(5)如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:2min内,A物质的平均反应速率为______。
【答案】四氧化三铁 氯化铁 氯酸钾 过氧化氢 MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O 2Fe+ 3C12= 2FeC13 0.4mol/(L·min)
MnCl2+C12↑+2H2O 2Fe+ 3C12= 2FeC13 0.4mol/(L·min)
【解析】
C为O2,若反应①是在加热条件下进行,则A是氯酸钾,若反应①是在常温条件下进行,则A是过氧化氢。D为C12,则B为浓盐酸,氯气与铁加热反应生成氯化铁,则H为氯化铁。铁在氧气中燃烧生成四氧化三铁,则F为四氧化三铁,四氧化三铁与盐酸反应生成氯化铁和氯化亚铁,则G为氯化亚铁。
(1)有分析可知,F为四氧化三铁,H为氯化铁;
(2)反应①是在二氧化锰作催化剂条件下制取氧气,若反应①是在加热条件下进行,则A是氯酸钾。若反应①是在常温条件下进行,则A是过氧化氢;
(3)B为浓盐酸,浓盐酸与MnO2共热生成氯气、氯化锰和水,化学方程式为MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O;
MnCl2+C12↑+2H2O;
(4)D为C12,E为Fe单质,氯气与铁共热生成氯化铁,化学方程式为2Fe+ 3C12= 2FeC13;
(5)2min内,A的物质的量浓度变化量=(2.0-1.2)mol/L=0.8mol/L,则A物质的平均反应速率=![]() =0.4mol/(L·min)。
=0.4mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个化学反应过程,图中的黑球表示两个相同的单糖或其单元。
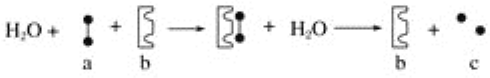
则图中的a、b、c分别表示( )
A. 麦芽糖 麦芽糖酶 葡萄糖
B. 蔗糖 蔗糖酶 果糖
C. 乳糖 乳糖酶 葡萄糖
D. 淀粉 淀粉酶 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得:

有关上述反应物和产物的叙述不正确的是
A.上述三种有机物中共有四种含氧官能团
B.贝诺酯分子中有9种不同化学环境的氢原子
C.1mol贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol
D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷和氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下图所示:
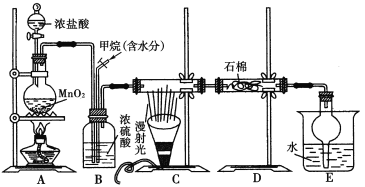
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②干燥混合气体;③________________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应____________。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:____________________________________。
(4)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为___________。该装置的主要缺陷是 。
(5)已知丁烷与氯气的取代反应的产物之一为C4H8Cl2,其有 种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验原理或操作方法的叙述中,正确的是( )
A. 实验室用乙酸,乙醇和浓硫酸制乙酸乙酯时,必须将温度控制在170℃
B. 向滴有酚酞的![]() 溶液中逐滴加
溶液中逐滴加![]() 溶液,红色褪去,说明
溶液,红色褪去,说明![]() 在水溶液中存在水解平衡
在水溶液中存在水解平衡
C. 实验室金属钠应保存在煤油中,也可保存在无水酒精中
D. 可以用澄清石灰水鉴别失去标签的![]() 溶液和
溶液和![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时2SO2(g)+O2(g)=2SO3(g)△H=﹣197kJmol﹣1,在相同温度下,向密闭容器通入2molSO2和1molO2达平衡时,放热Q1;向另一相同体积的密闭容器中通入1molSO2和0.5molO2达平衡时,放出热量Q2,则下列关系式正确的是( )
A.Q2=2Q1B.Q2<Q1<197kJC.Q2=Q1<197kJD.以上均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的血液的pH需控制在7.35~7.45之间,过高过低都会引起身体不适,甚至危及生命。人体血液能维持在稳定的pH范围主要是人血浆中一定浓度的![]() 和
和![]() 起调节作用。按要求回答下列问题。
起调节作用。按要求回答下列问题。
(1)用离子方程式解释血液呈弱碱性的原因____;
(2)当血液的![]() (即
(即![]() 浓度为
浓度为![]() )时,
)时,![]() 和
和![]() 浓度比值约为20:1,计算此时碳酸的
浓度比值约为20:1,计算此时碳酸的![]() ___;查阅资料得常温下碳酸的
___;查阅资料得常温下碳酸的![]() ,解释与计算所得数据存在差异的原因____。
,解释与计算所得数据存在差异的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com