
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.28g N2含有的原子数为NA
B.1mol Zn与足量盐酸反应失去的电子数为2NA
C.标准状况下22.4L水中含有的H2O分子数为NA
D.2mol /L NaCl溶液中含有Na+个数为2 NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得:

有关上述反应物和产物的叙述不正确的是
A.上述三种有机物中共有四种含氧官能团
B.贝诺酯分子中有9种不同化学环境的氢原子
C.1mol贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol
D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的血液的pH需控制在7.35~7.45之间,过高过低都会引起身体不适,甚至危及生命。人体血液能维持在稳定的pH范围主要是人血浆中一定浓度的![]() 和
和![]() 起调节作用。按要求回答下列问题。
起调节作用。按要求回答下列问题。
(1)用离子方程式解释血液呈弱碱性的原因____;
(2)当血液的![]() (即
(即![]() 浓度为
浓度为![]() )时,
)时,![]() 和
和![]() 浓度比值约为20:1,计算此时碳酸的
浓度比值约为20:1,计算此时碳酸的![]() ___;查阅资料得常温下碳酸的
___;查阅资料得常温下碳酸的![]() ,解释与计算所得数据存在差异的原因____。
,解释与计算所得数据存在差异的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④CO2;⑤蔗糖晶体;⑥Ca(OH)2;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(a)上述物质中属于电解质的有_____________,非电解质的有_____________(填序号)。
(b)②在水溶液中的电离方程式为____________________________________________
(c)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,如果病人同时患胃溃疡,为防胃壁穿孔,不宜服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:_____
(d)若⑦中混有少量的③,提纯的方法是:_________
A.蒸馏 B.萃取 C.渗析 D.分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物。它们之间存在如下关系(反应中生成的水及次要产物均已略去):
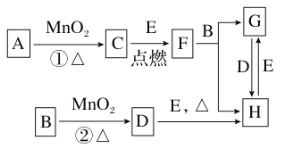
(1)写出下列物质的化学式:B________,E________。
(2)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是________剂。
(3)若反应①是在加热条件下进行,则A是________(填化学式);若反应①是在常温条件下进行,则A是________(填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
![]()
反应②的化学方程式为____________________________________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、B:![]() 、C:CH3COOH。
、C:CH3COOH。
(1)写出化合物A、C中官能团的名称:___________、_______。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是______(写名称),该反应的化学方程式为____。该物质在农业上用作水果的________。
(3)B的名称是_______,它的分子具有______(填分子构型)结构,是否存在单双键交替结构?___(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一可表示如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com