
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.分析 (1)根据反应物和生成物确定反应的方程式;计算出x值,可列式计算物质的量之比;
(2)根据得失电子守恒和化学式中元素化合价代数和为零解答,铁酸锌高温被H2还原生成氧缺位铁酸锌,依据原子守恒配平书写化学方程式.
解答 解:(1)CH4将氮氧化物(用NOx表示)催化还原为N2同时生成二氧化碳和水,反应的方程式为xCH4+4NOx$\frac{\underline{\;催化剂\;}}{\;}$xCO2+2N2+2xH2O,
现有1L由NO、NO2组成的混合气体,若将其还原为N2、需同温同压下0.4LCH4,则x:4=0.4:1,可知x=1.6,故氮氧化物的分子式为NO1.6,
设NO为xmol,NO2为ymol,
则$\frac{x+2y}{x+y}$=1.6,
解之得:x:y=2:3,
故答案为:xCH4+4NOx$\frac{\underline{\;催化剂\;}}{\;}$xCO2+2N2+2xH2O;2:3;
(2)新型纳米材料ZnFe2OX可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2OX与SO2反应可生成0.75molS,则ZnFe2OX被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.75mol×4,解得,a=2.25,利用化合价代数和为零,2+2.25×2=2x,解得x=3.25,由铁酸锌高温被H2还原生成氧缺位铁酸锌的化学方程式4ZnFe2O4+3H2$\frac{\underline{\;\;△\;\;}}{\;}$ 4ZnFeO3.25+3H2O,
故答案为:3.25;4ZnFe2O4+3H2$\frac{\underline{\;\;△\;\;}}{\;}$ 4ZnFeO3.25+3H2O.
点评 本题比较综合,考查了氧化还原、方程式的书写、原子守恒的计算应用等知识,解答时须熟练掌握氧化还原反应的原理,题目难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).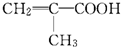 .
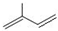
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$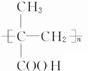 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;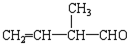 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
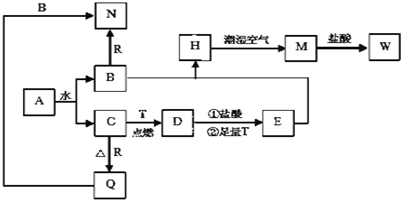
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
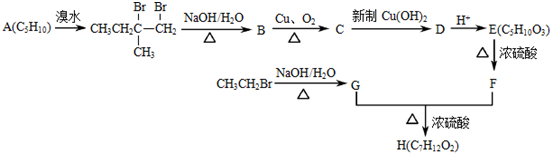
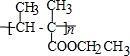 .
.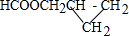 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com