
【题目】有两个密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入1molN2和3mol H2的混合气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:N2(g)+ 3H2(g) ![]() 2NH3(g) 。
2NH3(g) 。
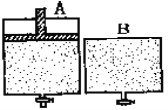
(1)达到平衡时所需的时间:A___ B,N2的转化率:A___B(填“大于”、“小于”或“等于”,下同)
(2)都达平衡后,两容器中分别通入1mol氩气,再达平衡后,N2的转化率:A中_____ B中 _____ (填“增大”、“减小”或“不变”)
(3)都达平衡后,向两容器中再通入1molN2和3mol H2 ,再达到平衡后:混合气体的密度:A中____ B中_____(填“增大”、“减小”或“不变”,下同);混合气体的平均相对分子质量:A中___B中 ______。
【答案】小于 大于减小不变不变增大不变增大
【解析】
(1)N2(g)+ 3H2(g) ![]() 2NH3(g)合成氨的反应是气体物质的量减小的反应。A是恒温恒压条件,B是恒温恒容条件,所以A中随反应进行相当于气体的体积减小,浓度增大,所以达到平衡的时间比B的短,由于是气体体积数减小的反应,所以加压平恒正向移动,故A中的转化率大于B的转化率。答案:小于、大于。
2NH3(g)合成氨的反应是气体物质的量减小的反应。A是恒温恒压条件,B是恒温恒容条件,所以A中随反应进行相当于气体的体积减小,浓度增大,所以达到平衡的时间比B的短,由于是气体体积数减小的反应,所以加压平恒正向移动,故A中的转化率大于B的转化率。答案:小于、大于。
(2) 都达平衡后,两容器中分别通入1mol氩气,A是恒压条件相当于增大容器的体积,减小压强,平衡逆向移动,再达平衡后N2的转化率降低了;B是恒容条件,通入1mol氩气A,分压不变,平衡不移动,所以B中转化率不变。答案:减小、不变。
(3)都达平衡后,向两容器中再通入1molN2和3mol H2 ,再达到平衡后,因为A是恒温恒压条件,根据公式p=m/V和M=m/n知混合气体的密度不变,混合气体的平均相对分子质量也不变,;B是恒温恒容条件,根据公式p=m/V和M=m/n知混合气体的密度增大,混合气体的平均相对分子质量也增大;答案:不变、增大、不变.、增大。


科目:高中化学 来源: 题型:
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为____________________;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)下列说法中能说明该反应达到了化学平衡状态的是___________________________。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为___________________kJ。
(5)已知:该反应的平衡常数随温度的变化如下表:
温度/℃ | 150 | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为__________________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO—和Cl—,在75℃以上和浓碱溶液中主要产物是ClO3—和Cl—。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。回答下列问题:
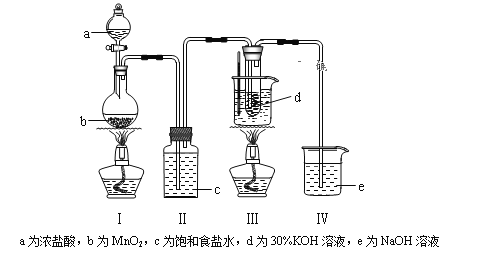
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。
①写出装置Ⅰ中反应的化学方程式为____________________________。
②若取消装置Ⅱ,对本实验的影响是____________________________。
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是_______。
(2)已知碱性条件下,ClO—有强氧化性,而ClO3—氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO—氧化,而不能被ClO3—氧化。_________________。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3—+6I—+6H+=Cl—+3I2+3H2O)
步骤4:加入指示剂,用0.5000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O32—+I2=S4O62—+2I—)
①步骤2的目的是________。写出煮沸时反应的化学方程式________。
②样品中KClO3的质量分数为________。(KClO3相对分子质量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容容器中加入amol A使 A(g) ![]() B(?)+C(?)达到平衡状态(△H>0),升高温度,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
B(?)+C(?)达到平衡状态(△H>0),升高温度,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
A. B和C可能都是固体 B. B和C一定都是气体
C. 若C为固体,则B不一定是气体 D. B和C可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.灼烧至红热的细铁丝与氯气反应生成FeCl2
B.常温常压下,22.4L SO2中含有的分子数为6.02×1023
C.纯碱溶液呈碱性,热的纯碱溶液可以去除物品表面的油污
D.Na2O2能与水或CO2反应生成O2,可用作呼吸面具中的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________________。
(4)比较Y、Z气态氢化物的稳定性________>________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:

(1)若A、B、C均为化合物且焰色反应均为黄色,水溶液均为碱性。则C物质的化学式是_____________。
(2)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为___________。(写元素符号)
②该金属元素的单质与某红棕色粉末在高温下反应,可用于焊接铁轨,反应的化学反应方程式为__________。
若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构。C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com