
【题目】恒容容器中加入amol A使 A(g) ![]() B(?)+C(?)达到平衡状态(△H>0),升高温度,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
B(?)+C(?)达到平衡状态(△H>0),升高温度,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
A. B和C可能都是固体 B. B和C一定都是气体
C. 若C为固体,则B不一定是气体 D. B和C可能都是气体
【答案】D
【解析】
A(g)B(?)+C(?)(△H>0),该正反应吸热反应,温度升高,平衡右移,气体平均相对分子质量变小。平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定;
A. 由上边分析知B和C肯定不会都是固体,若都是固体,气体物质的量减小,质量减小,气体平均相对分子质量不一定减小,故A错误;B.若都是气体,反应后气体物质的量一定增大,质量不变,气体平均相对分子质量减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,气体平均相对分子质量减小,故B错误;C.C为固体,B一定为气体,反应前后气体物质的量不变,气体质量减小,气体平均相对分子质量减小,故C错误;D.B和C可能都是气体时,质量守恒,反应后气体物质的量增大,气体平均相对分子质量减小,故D正确;答案:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关过渡元素的说法正确的是( )
A.新型高效催化剂多与过渡元素有关
B.高效低毒农药多与过渡元素有关
C.过渡元素中只有铁、锰等少数元素存在变价
D.过渡元素的单质不能与酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容时,N2O4 ![]() 2NO2已达平衡状态。现做如下改变:①加入一定量的NO2;②加入一定量的N2O4,二者均再达平衡状态后, NO2和N2O4的物质的量之比值,应( )
2NO2已达平衡状态。现做如下改变:①加入一定量的NO2;②加入一定量的N2O4,二者均再达平衡状态后, NO2和N2O4的物质的量之比值,应( )
A. ①中增大②中减小 B. ①中减小②中增大 C. 均增大 D. 均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.Al2O3熔点高,可用作耐高温材料B.晶体硅熔点高,可用作半导体材料
C.漂白粉在空气中不稳定,可用于漂白纸张D.Na具有还原性,可用于制作高压钠灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入1molN2和3mol H2的混合气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:N2(g)+ 3H2(g) ![]() 2NH3(g) 。
2NH3(g) 。
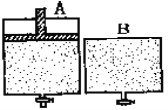
(1)达到平衡时所需的时间:A___ B,N2的转化率:A___B(填“大于”、“小于”或“等于”,下同)
(2)都达平衡后,两容器中分别通入1mol氩气,再达平衡后,N2的转化率:A中_____ B中 _____ (填“增大”、“减小”或“不变”)
(3)都达平衡后,向两容器中再通入1molN2和3mol H2 ,再达到平衡后:混合气体的密度:A中____ B中_____(填“增大”、“减小”或“不变”,下同);混合气体的平均相对分子质量:A中___B中 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4 ℃、118 ℃、77.1 ℃)。

乙酸乙酯的制取装置
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是__________。
(3)若用1 mol乙醇和1 mol 乙酸在浓硫酸作用下加热,充分反应,能否________(填“能或不能”)生成1mol乙酸乙酯,其原因是___________。
(4)反应开始时用酒精灯对圆底烧瓶小火加热的原因是___________________________。
(5)分离锥形瓶中所得乙酸乙酯和碳酸钠溶液的操作为(只填名称)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原SiHCl3(沸点:31.85℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )

A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氧氧化钠稀溶液与氯化铵固体反应制备氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com