
����Ŀ�����������Һ��Ӧ���ڵ��º�ϡ����Һ����Ҫ������ClO����Cl������75�����Ϻ�Ũ����Һ����Ҫ������ClO3����Cl�����о�С��������ʵ��װ����ȡ�����(KClO3)�����ⶨ�䴿�ȡ��ش��������⣺
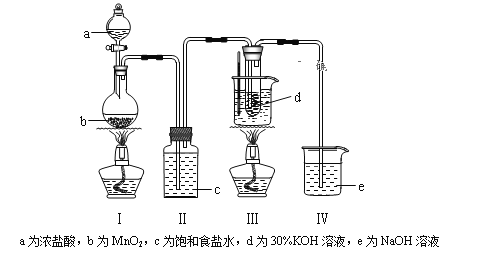
(1)���װ�������Ժ�����ҩƷ����װ�â�ˮ������75�濪ʼ��Ӧ��
��д��װ�â��з�Ӧ�Ļ�ѧ����ʽΪ____________________________��
����ȡ��װ�âԱ�ʵ���Ӱ����____________________________��
��ʵ����������װ�â�ǰΪ�˷�ֹ���������ݳ����ɲ�ȡ�Ĵ�ʩ��_______��
(2)��֪���������£�ClO����ǿ�����ԣ���ClO3�������Ժ��������ʵ��֤�������������£�H2O2�ܱ�ClO�������������ܱ�ClO3��������_________________��
(3)Ϊ�ⶨ��ƷKClO3�Ĵ��ȣ���������ʵ�飺
����1��ȡ2.45g��Ʒ����ˮ���250mL��Һ��
����2��ȡ25.00mL��Һ����ƿ�У�����pH��10���μ�����H2O2��Һ�����Ȼ�������Һ1~2���ӣ���ȴ��
����3���������KI��Һ������μ�������ϡ���ᡣ(ClO3��+6I��+6H+��Cl��+3I2+3H2O)
����4������ָʾ������0.5000 mol��L��1Na2S2O3����Һ�ζ����յ㣬���ı���Һ20.00mL��(2S2O32��+I2��S4O62��+2I��)
�ٲ���2��Ŀ����________��д�����ʱ��Ӧ�Ļ�ѧ����ʽ________��
����Ʒ��KClO3����������Ϊ________��(KClO3��Է���������122.5)
���𰸡�4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O ����HCl����KOH��ʹKClO3���ʽ��� ��װ�â��е���Һ�ӷ�Һ©��ע��Բ����ƿ�� KCl �ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ��A�������ݲ�������ʹ�����ǵ�ľ����ȼ��B���������������ߣ��ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ�����Ȼ�������Һ1~2���ӣ���ȴ���ֱ��������ϡ�����ữ���μ�AgNO3��Һ��A�в�����ɫ������B������������ ��ȥClO�� 2H2O2
MnCl2+Cl2��+2H2O ����HCl����KOH��ʹKClO3���ʽ��� ��װ�â��е���Һ�ӷ�Һ©��ע��Բ����ƿ�� KCl �ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ��A�������ݲ�������ʹ�����ǵ�ľ����ȼ��B���������������ߣ��ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ�����Ȼ�������Һ1~2���ӣ���ȴ���ֱ��������ϡ�����ữ���μ�AgNO3��Һ��A�в�����ɫ������B������������ ��ȥClO�� 2H2O2![]() 2H2O + O2�� 83.3%
2H2O + O2�� 83.3%
��������
��װ��I�ж���������Ũ���ᷴӦ�����Ȼ��̡�������ˮ;��װ��I��Ϊ����ʳ��ˮ,���Գ�ȥ�����е��Ȼ���;��������������Һ����װ��I�е�����;�����������Һ��Ӧ,�ڵ��¡�ϡ����Һ����Ҫ������ClO-��Cl- ,��75��C���ϡ�Ũ����Һ����Ҫ������ClO3-��Cl-��(2)�ٲ���2���ڼ�������ClO- ��H2O2��ԭΪCl-,������п���ʹ������H2O2�ֽ�;�ڸ�������,����������, ClO-������H2O2��ClO3-��������H2O2 ;�۸���ClO- +6I- +6H+=Cl- +3I2+3H2O��2S2O32��+I2��S4O62��+2I��,�ɵ÷�Ӧ�Ĺ�ϵʽClO3- ---6S2032-���ù�ϵʽ������Ʒ��KClO3������������
(1) ��װ���ж���������Ũ���ᷴӦ�����Ȼ��̡�������ˮ,��Ӧ���ӷ���ʽ��4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��װ��I��Ϊ����ʳ��ˮ,���Գ�ȥ���е��Ȼ���,��ȡ��װ��II ,����HCl����������������,ʹKClO3���ʽ���;
��ʵ��������װ��ǰΪ�˷�ֹ�������ݳ�,�ɲ�ȡ�Ĵ�ʩ�ǽ�װ��V�е�����������Һ�ӷ�Һ©����ע��Բ����ƿ;�ܚ��������Һ��Ӧ�ڵ��¡�ϡ����Һ����Ҫ������ClO-��Cl- ,��75�����ϡ�Ũ����Һ����Ҫ������ClO-��Cl- ,���Դ�װ��III���Թ��з���õ�KClO3�ֲ�Ʒ�����л��е�������KClO��KCl;
(2) �ٲ���2���ڼ�������ClO-��H2O2��ԭΪC1- ,��Ӧ�����ӷ���ʽ��2H2O2![]() 2H2O + O2��;������п���ʹ������H2O2�ֽ�,����С���Ŀ����ʹ������H2O2�ֽ�,��ֹ������KI;
2H2O + O2��;������п���ʹ������H2O2�ֽ�,����С���Ŀ����ʹ������H2O2�ֽ�,��ֹ������KI;
�ڸ�������,����������, ClO-������H2O2 , CIO-��������H2O2 ,����������ClO3- <C10- ;����25.00mL��Һ�к���KClO3������Ϊxg ;
KCl03---6S2032-
122.5g 6mol
X 0.5mol/L![]() 0.02L
0.02L
X=0.204g ��Ʒ��KCIO3����������Ϊ0.245 ![]() 100%= 83.3%���𰸣�83.3%��
100%= 83.3%���𰸣�83.3%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��10 mLһ�����ʵ���Ũ�ȵ����ᱻһ�����ʵ���Ũ�ȵ�NaOH��Һ�ζ���ͼʾ����ͼ����ͼ�Ƴ�NaOH��Һ����������ʵ���Ũ����ȷ����

A | B | C | D | |
c(HCl) | 0.12 | 0.04 | 0.12 | 0.09 |
c(NaOH) | 0.04 | 0.12 | 0.06 | 0.03 |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����Ŀǰȼ��ȼ��ʱ�����Ļ�����Ⱦ��ͬʱ������ԴΣ�����й�ר�����������̫������ȡ���ܵĹ��롣����˵����ȷ����
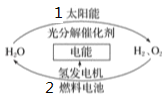
A. ����1�Ƿ��ȷ�Ӧ
B. ����2�ɽ���ѧ��ת��Ϊ����
C. ����Դ�ɴ���Ȼ��ֱ�ӻ�ȡ����һ����Դ
D. ����������������䣬�������ü�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع���Ԫ�ص�˵����ȷ����( )
A.����Ч�����������Ԫ���й�
B.��Ч�Ͷ�ũҩ�������Ԫ���й�
C.����Ԫ����ֻ�������̵�����Ԫ�ش��ڱ��
D.����Ԫ�صĵ��ʲ������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��100 0 mol��L��1������ζ�20��00 mLδ֪Ũ�ȵİ�ˮ���ζ�������ͼ��ʾ���μ�20��00 mL����ʱ������Һ��c(Cl��)��c(NH4+)+c(NH3��H2O)+c(NH3)������˵���������

A. �ð�ˮ��Ũ��Ϊ0��100 0 mol��L��1
B. �����Һ��c(NH4+)+c(NH3��H2O)+c(NH3)��2c(Cl��)
C. �����Һ��c(NH4+)��c(Cl��)
D. �����Һ��c(Cl��)>c(H+)>c(NH4+)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��Zn��s����1/2O2��g����ZnO��s�� ��H����348.3kJ��mol��1����
��2��2Ag��s����1/2O2��g����Ag2O(s)�� ��H����31.0kJ��mol��1��
��Zn��s����Ag2O��s����ZnO��s����2Ag��s���ġ�H����
A. ��317.3kJ��mol��1 B. ��379.3kJ��mol��1 C. ��332.8kJ��mol��1 D. ��317.3kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º���ʱ��N2O4 ![]() 2NO2�Ѵ�ƽ��״̬���������¸ı䣺�ټ���һ������NO2��������һ������N2O4�����߾��ٴ�ƽ��״̬�� NO2��N2O4�����ʵ���֮��ֵ��Ӧ�� ��
2NO2�Ѵ�ƽ��״̬���������¸ı䣺�ټ���һ������NO2��������һ������N2O4�����߾��ٴ�ƽ��״̬�� NO2��N2O4�����ʵ���֮��ֵ��Ӧ�� ��
A. ����������м�С B. ���м�С�������� C. ������ D. ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ����1molN2��3mol H2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ�����ڱ���400���������ʹ֮�������·�Ӧ��N2(g)+ 3H2(g) ![]() 2NH3(g) ��
2NH3(g) ��
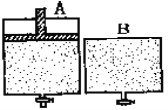
��1���ﵽƽ��ʱ�����ʱ�䣺A___ B��N2��ת���ʣ�A___B������ڡ�����С�ڡ����ڡ�����ͬ��
��2������ƽ����������зֱ�ͨ��1mol������ٴ�ƽ���N2��ת���ʣ�A��_____ B�� _____ �����������С�����䡱��
��3������ƽ���������������ͨ��1molN2��3mol H2 ���ٴﵽƽ����������ܶ�:A��____ B��_____�����������С�����䡱����ͬ������������ƽ����Է���������A��___B�� ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ж�����Ԫ�����ʵ������жϣ�����˵����ȷ����
|
|
|
|
|
|
|
| |
ԭ�Ӱ뾶 |
|
|
|
|
|
|
|
|
��ۻ���ͼ� |
|
|
|
|
|
|
|
|
A. Ԫ��![]() �γɵ��⻯���ȶ�
�γɵ��⻯���ȶ�
B. Ԫ��![]() �ķǽ���ǿ�������⻯��ķе��
�ķǽ���ǿ�������⻯��ķе��
C. Ԫ��![]() �γɵĻ������ǹ��ۻ�����
�γɵĻ������ǹ��ۻ�����
D. Ԫ��![]() ������������Ӧˮ����ļ�����ǿ
������������Ӧˮ����ļ�����ǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com