
【题目】常温下,用0.100 0 mol·L-1的盐酸滴定20.00 mL未知浓度的氨水,滴定曲线如图所示,滴加20.00 mL盐酸时所得溶液中c(Cl-)=c(NH4+)+c(NH3·H2O)+c(NH3)。下列说法错误的是

A. 该氨水的浓度为0.100 0 mol·L-1
B. 点①溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=2c(Cl-)
C. 点②溶液中c(NH4+)=c(Cl-)
D. 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-)
【答案】D
【解析】
本题主要考查酸碱中和相关曲线分析。
A.由题可知,当滴加20mL盐酸时,溶液中溶质为NH4Cl,由此可求出氨水的浓度;
B.点①溶液中溶质为等浓度NH4Cl和NH3H2O的混合溶液,依据物料守恒判断;
C.点②依据电荷守恒判断;
D.点③时氨水和氯化氢恰好完全反应,反应后溶质为氯化铵。
A.由图象曲线变化可知,加入20mL盐酸时出现滴定飞跃,说明氨水与盐酸的浓度相等,所以该氨水的物质的量浓度为0.1000mol/L,故A正确;
B.点①时滴入10mL盐酸,由于盐酸与氨水浓度相等,反应后溶质为等浓度的NH4Cl和NH3H2O,根据物料守恒可知:c(NH4+)+c(NH3H2O)+c(NH3)=2c(Cl-),故B正确;
C.点②时溶液为中性,则c(H+)=c(OH-),根据溶液中的电荷守恒可知:c(NH4+)=c(Cl-),故C正确;
D.点③时NH3H2O和HCl恰好完全反应,反应后溶质为NH4Cl,铵根离子部分水解,溶液呈酸性,由于水解程度较小,则c(Cl-)>c(NH4+)、c(H+)>c(OH-),由于水解程度较小,则c(NH4+)>c(H+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】可用下面图象表示的是( )

反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2 mol SO2和 1 mol O2 | 2 mol SO2和 2 mol O2 |
B | 一定质量的氮气和氢气,在同一固定容积的容器中反应 | 氨气的浓度 | 400 ℃ | 500 ℃ |
C | 2 mol SO2与1 mol O2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106 Pa | 1×105 Pa |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
B. 常温下,224 mL H2O中所含氢氧键的数目约为0.02NA
C. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO—和Cl—,在75℃以上和浓碱溶液中主要产物是ClO3—和Cl—。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。回答下列问题:
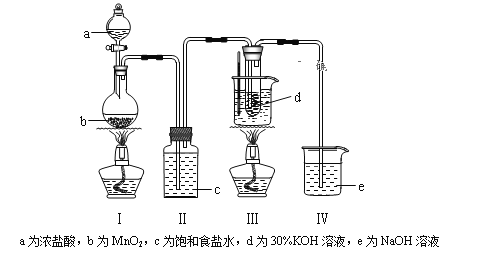
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。
①写出装置Ⅰ中反应的化学方程式为____________________________。
②若取消装置Ⅱ,对本实验的影响是____________________________。
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是_______。
(2)已知碱性条件下,ClO—有强氧化性,而ClO3—氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO—氧化,而不能被ClO3—氧化。_________________。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3—+6I—+6H+=Cl—+3I2+3H2O)
步骤4:加入指示剂,用0.5000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O32—+I2=S4O62—+2I—)
①步骤2的目的是________。写出煮沸时反应的化学方程式________。
②样品中KClO3的质量分数为________。(KClO3相对分子质量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响空气质量的一组主要污染物是( )
A.SO2、NO2、可吸入颗粒物
B.CO2、N2、O2
C.CO2、O2、SO2
D.NO2、N2、可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com