
【题目】下列离子方程式书写正确的是( )
A.碘化亚铁中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.1molL﹣1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O
D.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
【答案】C
【解析】
A. 碘化亚铁中通入过量氯气,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故A错误;
B. 明矾溶液的溶质为KAl(SO4)2,向其中滴入Ba(OH)2溶液使SO42-恰好完全沉淀时,铝元素以偏铝酸根离子形式存在,其离子方程式为:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O,故B错误;
C. 1molL-1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合,两者的物质的量之比为:2:5,反应的离子方程式为:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O,故C正确;
D. 用铜作电极电解CuSO4溶液与电解精炼铜的原理相同,阳极铜失电子生成Cu2+,阴极Cu2+得电子生成铜单质,故D错误;
答案选C。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列对有关微粒结构的表示或说法不正确的是( )
A.氮分子的电子式为::N:::N:
B.氨分子的空间构型为三角锥型,属于极性分子
C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子
D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是( )
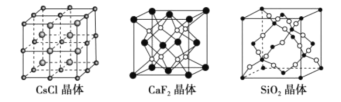
A.在CsCl晶体中,距Cs+最近的Cl-有6个
B.在CaF2晶体中,Ca2+周围距离最近的F-有4个
C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子
D.在SiO2晶体中,最小环上有12个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
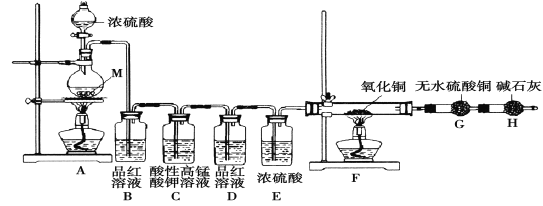
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后_________________________,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式:______________________;
(3)若假设2正确,则可观察到:F管中_____________;G干燥管里______________。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法:________。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为__________。试写出烧瓶里发生反应的总化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系 ,回答下列问题
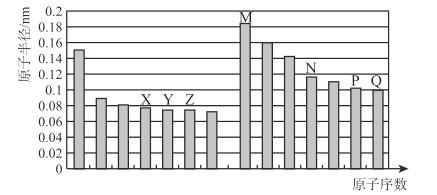
(l)N在周期表中的位置是 _______________。
(2)X、Y、P、Q 四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种的物质是 ______________。
(3)用电子式表示化合物MQ 的形成过程_______________。
(4)Y最高价氧化物对应的水化物的稀溶液与金属 Cu 反应的化学方程式是________。
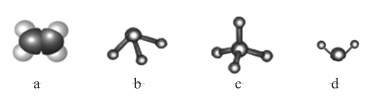
(5)元素 X 和氢元素可以形成多种化合物,下图模型表示的分子中,不可能由 X 和氢元素形成的是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取 Br2与 MgCl2 6 H2O 的流程如下:
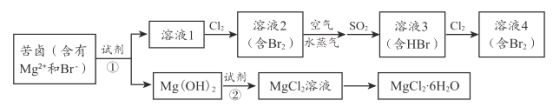
(1)为节约成本 ,试剂①最好选用____________。[填“NaOH”或“Ca( OH )2”]
(2)提取溴过程中,从溶液 l 到溶液 4 , 两次进行 Br -→Br2的转化,目的是____。
(3)提取溴过程中,形成溶液 3 的化学方程式是___________________ 。
(4)用原子结构原理解释Cl2的氧化性强于 Br2的原因 ___________________。
(5)提镁过程中,加入试剂②发生反应的离子方程式是 _________________。
(6)从 MgCl2溶液获得MgCl26 H2O晶体的主要操作为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。己知它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性,广泛地应用于照相等工业中。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
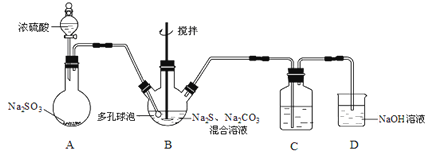
(1)装置A中发生反应的化学方程式是_____________。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为_____________________,生成的硫代硫酸钠粗品可用_______________洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是___________,表明SO2吸收效率低的实验现象是C中溶液颜色很快褪色。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是__________(写出-条)。
(4)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_______________________。
(5)粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250mL的溶液待用。另取25mL 0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________________。(己知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(A)的结构特殊,根据如下转化判断下列说法正确的是( )
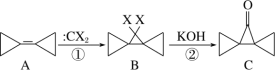
A.反应①、②分别是加成反应和消去反应
B.有机物A 的二氯代物有 4 种(不考虑立体异构)
C.有机物 B 的所有原子都在一个平面内
D.有机物C 的同分异构体中,同时含有苯环和羟基的有 5 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com