
【题目】海水资源的利用具有广阔的前景。从海水中提取 Br2与 MgCl2 6 H2O 的流程如下:
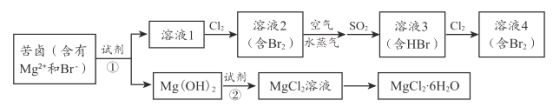
(1)为节约成本 ,试剂①最好选用____________。[填“NaOH”或“Ca( OH )2”]
(2)提取溴过程中,从溶液 l 到溶液 4 , 两次进行 Br -→Br2的转化,目的是____。
(3)提取溴过程中,形成溶液 3 的化学方程式是___________________ 。
(4)用原子结构原理解释Cl2的氧化性强于 Br2的原因 ___________________。
(5)提镁过程中,加入试剂②发生反应的离子方程式是 _________________。
(6)从 MgCl2溶液获得MgCl26 H2O晶体的主要操作为_______________。
【答案】Ca(OH)2 富集溴 Br2+SO2+2H2O=2HBr+H2SO4 氯原子半径较小,得电子的能力更强 Mg(OH)2+2H+=Mg2++2H2O 蒸发浓缩、冷却结晶、过滤
【解析】
苦卤(含有Mg2+和Brˉ),加入试剂①得到Mg(OH)2沉淀和溶液1,则试剂①应为碱性物质,为降低成本最好选用Ca(OH)2;溶液1中含有溴离子,通入氯气将溴离子氧化成溴单质,利用空气和水蒸气将溴吹出,利用SO2将溴单质还原成HBr,得到溶液3,再利用氯气将溶液3中的溴离子氧化成溴单质,得到溶液4;Mg(OH)2与盐酸反应得到MgCl2溶液,蒸发浓缩、冷却结晶,过滤得到MgCl26H2O晶体。
(1)煅烧贝壳、石灰石等物质可以得到CaO,CaO与水反应可以得到Ca(OH)2,所以为节约成本,试剂①最好选用Ca(OH)2;
(2)海水中溴的含量较低,得到的溶液1中溴离子浓度较大,经过系列工序得到含溴离子浓度较大的溶液4,实现溴的富集;
(3)溴单质具有氧化性,可以将SO2氧化成SO![]() ,根据电子守恒和元素守恒可得化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
,根据电子守恒和元素守恒可得化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
(4)氯原子核外有3层电子,溴原子核外有4层电子,氯原子半径较小,得电子的能力更强,氧化性更强;
(5)提镁过程中,向氢氧化镁沉淀中加入盐酸可得氯化镁溶液,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
(6)从MgCl2溶液获得MgCl26 H2O晶体的主要操作为:蒸发浓缩、冷却结晶、过滤。


科目:高中化学 来源: 题型:
【题目】某药物中间体X的合成路线如下:
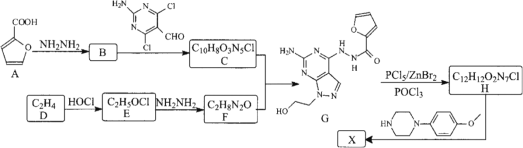
已知:①RX+![]()
![]()
![]() +HX; ②-NH2+RCHO
+HX; ②-NH2+RCHO![]() RCH=N-;
RCH=N-;
③R-OH![]() ; ④
; ④![]()
![]()
![]() 。
。
请回答:
(1) F的结构简式为________。
(2) 下列说法正确的是________。
A H→X的反应类型属于加成反应
B 化合物F具有弱碱性
C 化合物G能发生取代、消去、还原反应
D 化合物X的分子式为C23H27O3N9
(3) 写出B→C的化学方程式________。
(4) ![]() 可以转化为
可以转化为![]() 。设计以苯酚和乙烯为原料制备
。设计以苯酚和乙烯为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
(5) 写出化合物B同时符合下列条件的同分异构体的结构简式。
①分子中有一个六元环,无其它环状结构;________
②1HNMR谱表明分子中有2种氢原子;IR谱显示存在-CN________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 ( )
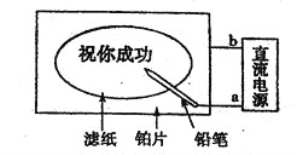
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.a点是负极,b点是正极
D.铅笔端有少量的氯气产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.碘化亚铁中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.1molL﹣1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O
D.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用![]() 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过
制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过![]()
D.由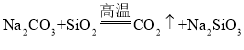 可知,硅酸的酸性强于碳酸
可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的一组是( )
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③碳原子数不同的直链烷烃一定是同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
A.①②③④B.②③④C.②③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的原子结构示意图_____________。
(2)根据等电子原理,写出CO分子的结构式____________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________________________。
②甲醛分子的空间构型是____________________;1 mol甲醛分子中σ键的数目为________。
II.在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是_________;只由非极性键构成的非极性分子是________;(填序号,下同)。
(2)既有非极性键,又有极性键构成的非极性分子是_________。
(3)既有离子键,又有共价键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
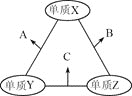
A.X元素位于第ⅥA族
B.A不能溶解于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
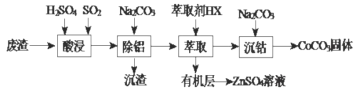
下列说法不正确的是( )
A.“酸溶”时发生氧化还原反应的离子方程式Co2O3+SO2+2H+=2Co2++H2O+SO42-
B.“除铝”过程中需要调节溶液 pH 的范围为5.0~5.4
C.在实验室里,“萃取”过程用到的玻璃仪器主要有分液漏斗、烧杯
D.在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为CoO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com