
【题目】I.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的原子结构示意图_____________。
(2)根据等电子原理,写出CO分子的结构式____________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________________________。
②甲醛分子的空间构型是____________________;1 mol甲醛分子中σ键的数目为________。
II.在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是_________;只由非极性键构成的非极性分子是________;(填序号,下同)。
(2)既有非极性键,又有极性键构成的非极性分子是_________。
(3)既有离子键,又有共价键的是________。
【答案】
![]() 甲醇分子间含有氢键 平面三角形 3NA ①③ ② ⑤ ④⑥
甲醇分子间含有氢键 平面三角形 3NA ①③ ② ⑤ ④⑥
【解析】
I.(1)根据锌的原子序数写基态Zn原子的原子结构示意图;
(2)根据CO与N2为等电子体,书写CO的结构式;
(3)①利用氢键来解释物质的沸点;
②利用杂化类型来分析空间结构,并利用判断σ键的规律来分析σ键数目;
II.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;正负电荷中心重合的分子为非极性分子;活泼金属和活泼非金属元素之间易形成离子键,据此分析解答。
I.(1)Zn的原子序数为:30,基态Zn原子的原子结构示意图为: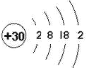 ,故答案为:
,故答案为: ;
;
(2)根据等电子原理,CO与N2为等电子体,N2分子的结构式为:![]() ,互为等电子体的结构相似,则CO分子的结构式为:
,互为等电子体的结构相似,则CO分子的结构式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高,故答案为:甲醇分子间含有氢键;
②甲醛分子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,则分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳氢σ键,1mol碳氧σ键,故含有σ键的数目为3NA,故答案为:平面三角形;3NA;
II. (1)不同非金属元素之间易形成极性键,所以只存在极性键的是①③;同种非金属元素之间易形成非极性键,正负电荷中心重合的分子为非极性分子,只由非极性键构成的非极性分子为②,故答案为:①③;②;
(2)C2H4的结构式为:![]() ,既有非极性键,又有极性键,且是非极性分子,故答案为:⑤;
,既有非极性键,又有极性键,且是非极性分子,故答案为:⑤;
(3)Na2O2中钠离子与过氧根离子间存在离子键,过氧根离子内氧原子与氧原子之间是非极性共价键;NaOH中钠离子和氢氧根离子之间存在离子键,HO原子之间存在极性共价键,所以Na2O2与NaOH中含有离子键,又含有共价键,故答案为:④⑥。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法不正确的是
A.钢铁腐蚀时化学能不能全部转化为电能
B.钢铁腐蚀的负极反应式为Fe-2e-=Fe2+
C.如图所示,将导线与金属锌相连可保护地下铁管
D.如图所示,将导线与外接电源的正极相连可保护地下铁管
查看答案和解析>>
科目:高中化学 来源: 题型:
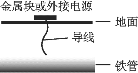
【题目】某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后_________________________,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式:______________________;
(3)若假设2正确,则可观察到:F管中_____________;G干燥管里______________。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法:________。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为__________。试写出烧瓶里发生反应的总化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
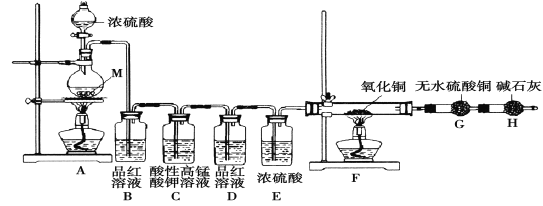
【题目】海水资源的利用具有广阔的前景。从海水中提取 Br2与 MgCl2 6 H2O 的流程如下:
(1)为节约成本 ,试剂①最好选用____________。[填“NaOH”或“Ca( OH )2”]
(2)提取溴过程中,从溶液 l 到溶液 4 , 两次进行 Br -→Br2的转化,目的是____。
(3)提取溴过程中,形成溶液 3 的化学方程式是___________________ 。
(4)用原子结构原理解释Cl2的氧化性强于 Br2的原因 ___________________。
(5)提镁过程中,加入试剂②发生反应的离子方程式是 _________________。
(6)从 MgCl2溶液获得MgCl26 H2O晶体的主要操作为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为基本原料可制备X、Y、Z、W等物质,下列有关说法中正确的是( )
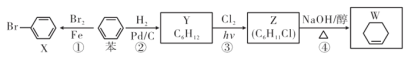
A. 反应①是苯与溴水的取代反应 B. 可用AgN03溶液检测W中是否混有Z
C. X、苯、Y分子中六个碳原子均共平面 D. 反应④中产物除W外还有H2O和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。己知它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性,广泛地应用于照相等工业中。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
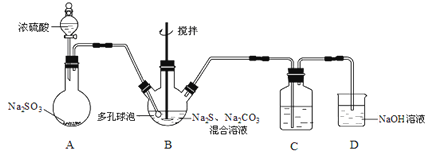
(1)装置A中发生反应的化学方程式是_____________。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为_____________________,生成的硫代硫酸钠粗品可用_______________洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是___________,表明SO2吸收效率低的实验现象是C中溶液颜色很快褪色。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是__________(写出-条)。
(4)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_______________________。
(5)粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250mL的溶液待用。另取25mL 0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________________。(己知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡是大名鼎鼎的“五金”-金、银、铜、铁、锡之一。SnCl4可用作媒染剂,可利用如下图所示装置可以制备SnCl4(部分夹持装置己略去);
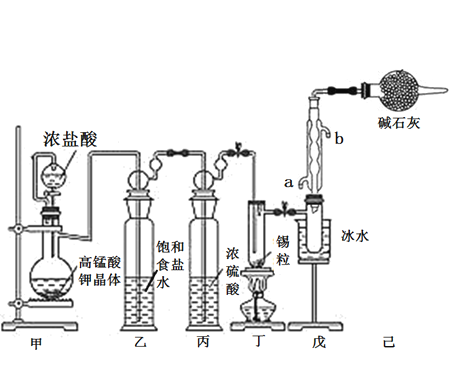
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为___________;戊装置中冷凝管的进水口为________(填“a”或“b”)。
(2)甲装置发生反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②__________________。
(4)己装置的作用是_______________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有__________(填标号)。
A.FeCl3溶液(滴有几滴KSCN溶液) B.溴水 C.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.苯甲酸共有4种同分异构体(含苯环且包括苯甲酸)
B.相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷
C.CH3COOCH3在核磁共振氢谱中有2种不同类型的氢原子
D.两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③是三种不同的氢分子B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子D. ①②③具有相同的质量数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com