
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。己知它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性,广泛地应用于照相等工业中。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
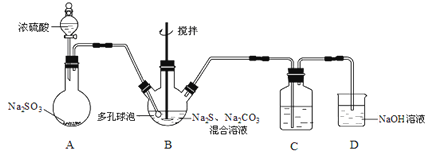
(1)装置A中发生反应的化学方程式是_____________。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为_____________________,生成的硫代硫酸钠粗品可用_______________洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是___________,表明SO2吸收效率低的实验现象是C中溶液颜色很快褪色。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是__________(写出-条)。
(4)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_______________________。
(5)粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250mL的溶液待用。另取25mL 0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________________。(己知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-)
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 4SO2+2S2-+CO32-=CO2↑+3S2O32 乙醇 品红、溴水或KMnO4溶液 控制SO2的流速(或增大SO2的接触面积或适当升高温度) S2O32-+2H+=S↓+SO2↑+H2O 62%
【解析】
装置A为二氧化硫的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫能和品红作用,二氧化硫能被高锰酸钾氧化,能与溴单质,上述溶液均褪色,所以装置C中盛放品红、溴水或KMnO4溶液,其作用是检验装置B中SO2的吸收效率,二氧化硫有毒,不能直接排放到空气中,装置D作用为尾气吸收装置,吸收未反应的二氧化硫;
(1)装置A为二氧化硫的制取,亚硫酸钠和浓硫酸发生复分解反应生成硫酸钠和水和二氧化硫;
(2)根据题目信息SO2、Na2S和Na2CO3反应生成Na2S2O3,结合质量守恒确定产物并配平,硫代硫酸钠晶体易溶于水,难溶于乙醇,生成的硫代硫酸钠粗品可用乙醇洗涤;
(3)装置B的作用是检验装置A中SO2的吸收效率,说明B中物质能与二氧化硫反应,且有明显的现象,一般可为品红、溴水或KMnO4溶液;要加快反应速率,可增大接触面积,增大浓度、升高温度等;
(4) 酸性条件下,S2O32-自身发生氧化还原反应生成SO2 、S和水;
(5) 依据反应的定量关系 2S2O32-~I2,计算碘单质消耗的硫代硫酸钠,计算得到样品的纯度。
(1)装置A为二氧化硫的制取,亚硫酸钠和浓硫酸发生复分解反应:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,生成二氧化硫;
(2)三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式为:4SO2+2Na2S+Na2CO3=CO2↑+3Na2S2O3,离子反应为:4SO2+2S2-+CO32-=CO2↑+3S2O32-,硫代硫酸钠晶体易溶于水,难溶于乙醇,乙醇易挥发,生成的硫代硫酸钠粗品可用乙醇洗涤;
(3)装置B的作用是检验装置A中SO2的吸收效率,说明B中物质能与二氧化硫反应,且有明显的现象,一般可为品红、溴水或KMnO4溶液等,如A中SO2吸收效率低,则B中进入较多的二氧化硫,导致B中溶液颜色很快褪色。要加快反应速率,可增大气体与液体的接触面积,增大浓度,减慢二氧化硫的流速、升高温度等;
(4) 硫代硫酸根离子和氢离子反应生成硫、二氧化硫和水,离子反应方程式为:S2O32-+2H+═S↓+SO2↑+H2O;
(5) Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-,得定量关系 Cr2O72-~6S2O32-~3I2,另取25mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25mL,n(Cr2O72-)=0.025L×0.0lmolL-1=0.00025mol,n(S2O32-)=0.00025mol×6=0.0015mol,粗品中Na2S2O35H2O的质量分数为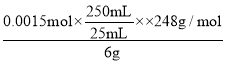 ×100%=62%。
×100%=62%。


科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的右图装置(夹持仪器未画出)进行定性实验。
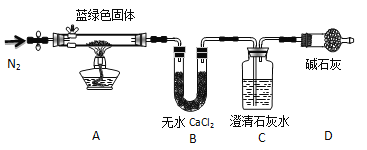
请回答下列问题:
(1)假设2中的沉淀为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的____ __。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设______(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.碘化亚铁中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.1molL﹣1的NaAlO2溶液和2.5molL﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O
D.用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的一组是( )
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③碳原子数不同的直链烷烃一定是同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
A.①②③④B.②③④C.②③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的原子结构示意图_____________。
(2)根据等电子原理,写出CO分子的结构式____________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________________________。
②甲醛分子的空间构型是____________________;1 mol甲醛分子中σ键的数目为________。
II.在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是_________;只由非极性键构成的非极性分子是________;(填序号,下同)。
(2)既有非极性键,又有极性键构成的非极性分子是_________。
(3)既有离子键,又有共价键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
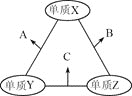
A.X元素位于第ⅥA族
B.A不能溶解于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元醇的结构简式![]() ,关于该有机物的说法错误的是( )
,关于该有机物的说法错误的是( )
A.用系统命名法命名:5-甲基-2,5-庚二醇
B.该有机物通过消去反应能得到 6 种不同结构的二烯烃(不考虑立体异构)
C.该有机物通过催化氧化后产物只有一种官能团
D.1mol 该有机物能与足量金属 Na 反应产生 H2 22.4L(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烷跟化合物之间的转化如图所示:

(1)写出各反应的化学方程式
①________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________,
⑤________________________________________________________________________。
(2)根据上述方程式回答下列问题:
A.上述化学反应的反应类型有________,________,________。
B.用AgNO3溶液通过________反应可证明卤代烃中含卤元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com