
【题目】简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③是三种不同的氢分子B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子D. ①②③具有相同的质量数
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的原子结构示意图_____________。
(2)根据等电子原理,写出CO分子的结构式____________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________________________。
②甲醛分子的空间构型是____________________;1 mol甲醛分子中σ键的数目为________。
II.在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是_________;只由非极性键构成的非极性分子是________;(填序号,下同)。
(2)既有非极性键,又有极性键构成的非极性分子是_________。
(3)既有离子键,又有共价键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
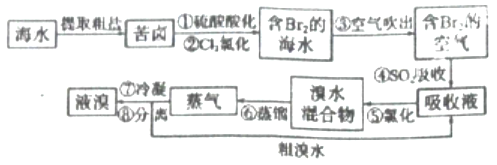
(1)步骤①中叫硫酸酸化可提高Cl2的利用率,理由是 。
(2)步骤④利用了SO2的还原性,反应的离子方程式为 。
(3)步骤⑥的蒸馏过程中,温度应控制在8090℃。温度过高或过低都不利于生产,请解释原因_______ 。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 。
(5)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
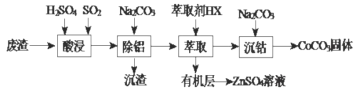
下列说法不正确的是( )
A.“酸溶”时发生氧化还原反应的离子方程式Co2O3+SO2+2H+=2Co2++H2O+SO42-
B.“除铝”过程中需要调节溶液 pH 的范围为5.0~5.4
C.在实验室里,“萃取”过程用到的玻璃仪器主要有分液漏斗、烧杯
D.在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为CoO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硅酸(H2SiF6)制备冰晶石(Na3AlF6)的工艺流程如图所示:
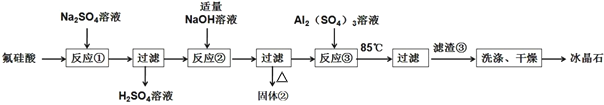
已知:冰晶石(Na3AlF6)微溶于水。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是_____。
(2)已知氟硅酸(H2SiF6)酸性强于硫酸,写出反应①的化学方程式______。
(3)反应②为脱硅工艺,固体②是_____。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为_____;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物_____。
(5)干燥前,检验冰晶石是否洗涤干净的实验方法是_____。
(6)从母液中可循环利用的物质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烷跟化合物之间的转化如图所示:

(1)写出各反应的化学方程式
①________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________,
⑤________________________________________________________________________。
(2)根据上述方程式回答下列问题:
A.上述化学反应的反应类型有________,________,________。
B.用AgNO3溶液通过________反应可证明卤代烃中含卤元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+![]() O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
B.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
C.500℃下,将0.5mol I2(g)和0.5molH2(g)置于密闭的容器中充分反应生成HI(g),放热10kJ,其热化学方程式为:I2(g) + H2(g)![]() 2HI(g) △H = -20kJmol-1
2HI(g) △H = -20kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室中过氧乙酸消毒液试剂瓶标签上的有关数据,回答下列问题:

(1)C2H4O3的物质的是浓度为___ mol·L-1。
(2)取用任意体积的该过氧乙酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中C2H4O3的物质的量
B.C2H4O3的物质的量浓度
C.溶液的密度
D.溶液中C2H4O3分子的数目
(3)某学生欲用上述溶液和蒸馏水配制480mL0.100mol·L-1过氧乙酸稀溶液。
①该学生需要选用的容量瓶规格是___ mL。
②该学生需要用量筒量取___ mL上述过氧乙酸溶液进行配制。
③在配制过程中,下列实验操作会使所配制的过氧乙酸的物质的是浓度偏大的是___ (填字母)。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.用量筒量取过氧乙酸溶液时俯视凹液面
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线
(4)室温下,过氧乙酸可以分解放出氧气并生成酷酸(C2H4O2),若取质量分数为15%的过氧乙酸溶液50.0mL,完全分解,理论上得到标准状况下的氧气体积为___ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。
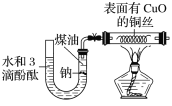
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________。
(2)U形管中溶液的颜色_____,说明有__________生成。
(3)铜丝的变化现象____________,说明有________生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com