
【题目】如图为实验室中过氧乙酸消毒液试剂瓶标签上的有关数据,回答下列问题:

(1)C2H4O3的物质的是浓度为___ mol·L-1。
(2)取用任意体积的该过氧乙酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中C2H4O3的物质的量
B.C2H4O3的物质的量浓度
C.溶液的密度
D.溶液中C2H4O3分子的数目
(3)某学生欲用上述溶液和蒸馏水配制480mL0.100mol·L-1过氧乙酸稀溶液。
①该学生需要选用的容量瓶规格是___ mL。
②该学生需要用量筒量取___ mL上述过氧乙酸溶液进行配制。
③在配制过程中,下列实验操作会使所配制的过氧乙酸的物质的是浓度偏大的是___ (填字母)。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.用量筒量取过氧乙酸溶液时俯视凹液面
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线
(4)室温下,过氧乙酸可以分解放出氧气并生成酷酸(C2H4O2),若取质量分数为15%的过氧乙酸溶液50.0mL,完全分解,理论上得到标准状况下的氧气体积为___ L。
【答案】2.25 BC 500 22.2 C 1.26
【解析】
(1)根据![]() 可得,C2H4O3的物质的是浓度为
可得,C2H4O3的物质的是浓度为![]() ,故答案为:2.25;
,故答案为:2.25;
(2)取用任意体积的该过氧乙酸溶液时,物质的量浓度和密度不变,物质的量和分子数会发生改变,选BC,故答案为:BC;
(3)某学生欲用上述溶液和蒸馏水配制480mL0.100mol·L-1过氧乙酸稀溶液。
①实验室没有480mL的容量瓶,应选用500mL的容量瓶,故答案为:500;
②根据![]() 可得,
可得,![]() ,
,![]() ,故答案为:22.2;
,故答案为:22.2;
③A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容,溶质物质的量减小,所配制的溶液浓度偏小,不选A;
B. 用量筒量取过氧乙酸溶液时俯视凹液面,所量取的过氧乙酸溶液偏小,物质的量偏小,所配制的溶液浓度偏小,不选B;
C. 在容量瓶中定容时俯视刻度线,所配溶液的体积偏小,则物质的量浓度偏大,选C;
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线,相当于稀释,所配制的溶液浓度偏小,D;故答案为:C。
(4)过氧乙酸的物质的量浓度为2.25mol/L,其物质的量为:0.05L×2.25mol/L=0.1125mol,根据反应方程式2CH3COOOH=2CH3COOH+O2↑,氧气的物质的量为:n=0.05625mol,则氧气的体积为:V=n·Vm=0.05625mol×22.4L/mol=1.26L,故答案为:1.26。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.苯甲酸共有4种同分异构体(含苯环且包括苯甲酸)
B.相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷
C.CH3COOCH3在核磁共振氢谱中有2种不同类型的氢原子
D.两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③是三种不同的氢分子B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子D. ①②③具有相同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质有如下转化关系![]() 有的生成物未列出
有的生成物未列出![]() ,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
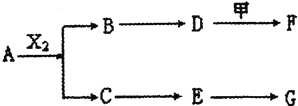
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 ______ ,R、X、T的原子半径从小到大的顺序为 ______ ![]() 用元素符号表示
用元素符号表示![]() ;
;
(2)A和G等物质的量反应产物的水溶液显 ______ 性,其原因用离子方程式表示为 ______ ;
(3)A和X2反应的化学方程式为 ______ ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ______ ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移1 mol电子时,生成的气体在标准状况下的总体积为 ______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是 ( )
①CS2为V形的极性分子 ②![]() 的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和
的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和![]() 的中心原子均采用sp3杂化
的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图1所示(部分产物已略去):
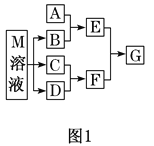
(1)写出B的电子式________。
(2)若A是一种非金属单质,且可用于制造半导体材料,写出A和B水溶液反应的离子方程式__________________________。
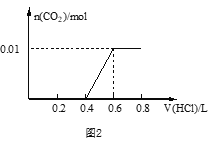
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图2所示,则A与B溶液反应后溶液中所有溶质的化学式为_____________;c(HCl)=________mol/L。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是______________________________________。
(5)若A是一种可用于做氮肥的化合物, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为___________________。
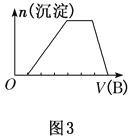
(6)若A是一种溶液,可能含有H+、NH![]() 、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子是_____________________,它们的物质的量浓度之比为______________。
、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子是_____________________,它们的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。A 有一种原子,中子数为零。B 原子的最外层电子数是电子层数的2倍。D元素原子的最外层电子数是次外层电子数的 3 倍。E元素的一种氧化物颜色为淡黄色。F与D同主族。请回答下列问题:
(1)B元素在周期表中的位置是_____,G的离子结构示意图为_____。
(2)F与G最高价氧化物的水化物的酸性强弱为_________>_________(填化学式)。
(3)简单D离子和E离子的半径大小关系为_____>_________(填离子符号)。
(4) B和D简单气态氢化物的稳定性强弱为_____<_____(填化学式)
(5) F的一种氧化物中氧的质量分数为50%,写出该氧化物与G单质水溶液反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
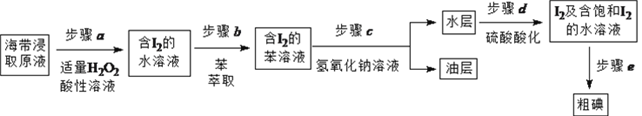
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
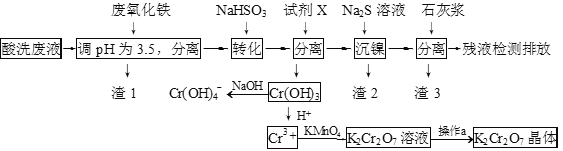
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
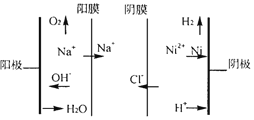
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com