
����Ŀ����ͼ��ʾ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ ���ش���������
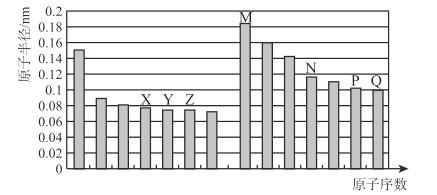
(l)N�����ڱ��е�λ���� _______________��
(2)X��Y��P��Q ����Ԫ�ص�����������ˮ�����У���ѧ�������Բ�ͬ���������ֵ������� ______________��
(3)�õ���ʽ��ʾ������MQ ���γɹ���_______________��
(4)Y����������Ӧ��ˮ�����ϡ��Һ����� Cu ��Ӧ�Ļ�ѧ����ʽ��________��
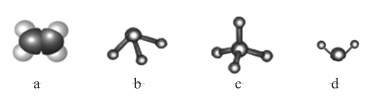
(5)Ԫ�� X ����Ԫ�ؿ����γɶ��ֻ������ͼģ�ͱ�ʾ�ķ����У��������� X ����Ԫ���γɵ���____________(�����)��
���𰸡�����������A�� H2CO3 ![]()
![]() bd
bd
��������
��ͼ�з�����֪����һ��Ԫ�ص�ԭ�Ӱ뾶�Ⱥ�����ڵ�����Ԫ��ԭ�Ӱ뾶��˵���䲻����Ԫ�أ����ǵڶ����ڵ�����Ԫ�غ͵������ڵ�����Ԫ�أ���X��Y��Z��M��N��P��Q�ֱ���C��N��O��Na��Si��S��Cl��Ȼ���ٽ��н��⡣
(l)N��SiԪ�أ��������ڱ��е�λ���ǵ���������A�壬�ʴ�Ϊ������������A�塣
(2)X��Y ��P��Q ����Ԫ�ص�����������ˮ����ֱ�ΪH2CO3��HNO3��H2SO4��HClO4�У�����H2CO3�����ᣬ�������־�Ϊǿ�ᣬ��H2CO3��ǿ�����ԣ��������������ǿ�����ԣ��ʻ�ѧ�������Բ�ͬ���������ֵ�������H2CO3���ʴ�Ϊ��H2CO3��
(3) ���ݷ�����֪MQ��ΪNaClΪ���ӻ���������γɹ����õ���ʽ���Ա�ʾΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)Y����������Ӧ��ˮ�����ϡ��Һ��ϡHNO3����� Cu ��Ӧ����Cu(NO3)2��NO��H2O���ʻ�ѧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(5)Ԫ�� X��̼Ԫ�غ���Ԫ�ؿ����γɶ��ֻ����������ͼ�п�֪��a����ϩ�ķ��ӱ���ģ�ͣ�b�ǰ��������ģ�ͣ�c�Ǽ�������ģ�ͣ�d��ˮ���ӵ����ģ�ͣ��ʲ������� Ԫ�� X��̼Ԫ�غ���Ԫ���γɵ� ������Ϊ��bd���ʴ�Ϊ��bd��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ���ͭ����![]() ������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
I��CuSO4��Һ���Ʊ�
�ٳ�ȡ4gͭ�ۣ���A����������10���Ӳ����Ͻ��裬������ȴ��
�����������м���30mL 3mol/L�����ᣬ��A�й��������������У����Ȳ����Ͻ��衣
�۳��ȹ��˵���ɫ��Һ��
(1)A����������Ϊ____��
(2)ijͬѧ��ʵ������1.5g��ͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��_____
II��������Ʊ�
�������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
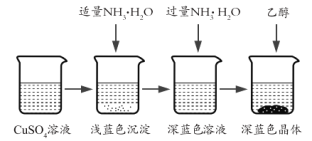
(3)��֪dz��ɫ�����ijɷ�Ϊ![]() ����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
(4)��������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����__��
III���������IJⶨ
��ȷ��ȡmg���壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ���VmL10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ���V1mL C1mol/L���������Һ��ȫ���ա�ȡ�½���ƿ����C2mol/L NaOH����Һ�ζ���ʣ��HCl(ѡ�ü�����ָʾ��)�����յ�ʱ����V2mLNaOH��Һ��
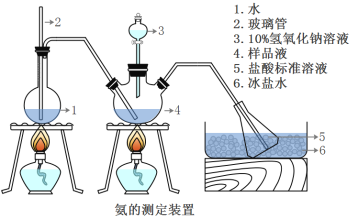
(5)Aװ���г������ܵ�����_____����Ʒ�а������������ı���ʽ_______��
(6)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����_______��
A���ζ�ʱδ��NaOH����Һ��ϴ�ζ���
B������ʱ���ζ�ǰƽ�ӣ��ζ�����
C���ζ�������ѡ�÷�̪��ָʾ��
D��ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ�����ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���R�Ľṹ��ʽ��ͼ��ʾ�������й�R������������ȷ���ǣ� ��
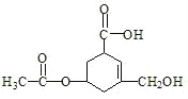
A.R������ԭ��һ����ͬһƽ����
B.��Ni���ͼ��������£�lmolR����3molH2�����ӳɷ�Ӧ
C.R���������ᡢ����Ӧ�����ܷ���ˮ�⡢�ӳɺ�������Ӧ
D.1molR������̼��������Һ��Ӧ������CO2�����ʵ���Ϊ2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ͨ������ʵ��̽�� KI ��FeCl3��Һ�ķ�Ӧ��ʵ����̺��������� ��
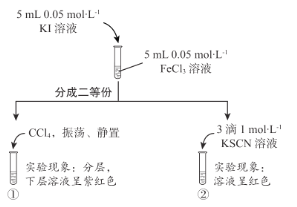
����˵������ȷ����
A.�Թܢ�������֤����I2����
B.�Թܢ�������֤����Һ�д���Fe3+
C.KI ��FeCl3��Һ�ķ�Ӧ����ʽΪ��2Fe3++ 2I-=2Fe2+ + I2
D.�ۺϸ�ʵ�����֪��Fe3+��I2������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.�⻯������ͨ�����������2Fe2+��2I����2Cl2��2Fe3+��I2��4Cl��
B.������Һ�е���Ba(OH)2��ҺʹSO42-ǡ����ȫ������2Ba2����3OH����Al3����2SO42-��2BaSO4����Al(OH)3��
C.1molL��1��NaAlO2��Һ��2.5molL��1��HCl��Һ�����������Ȼ�ϣ�2AlO2��+5H+=Al3++Al(OH)3��+H2O
D.��ͭ���缫���CuSO4��Һ��2Cu2����2H2O![]() 2Cu��O2����4H��
2Cu��O2����4H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��ԭ���������ȷ����

A.ϴ�ӳ���ʱ(��ͼ2)����©���м���������ˮ�����貢�˸�
B.ѡ����ʵ��Լ�����ͼ1��ʾװ�ÿɷֱ���ȡ����CO2��NO��O2
C.����ˮ�����Һ©�����������Ҵ������ã��ɽ�����ȡ���Ҵ���
D.��ȥ����CO2�л��е�����SO2���ɽ������������ͨ��ʢ����������KMnO4��Һ��Ũ�����ϴ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��ȫ����ȷ��һ���ǣ� ��
��CH3��CH=CH2��CH2=CH2�����ʽ��ͬ
��CH��CH��C6H6��̼����ͬ
��̼ԭ������ͬ��ֱ������һ����ͬϵ��
�������顢�����顢������ķе����
�ݱ�״���£�11.2L�ļ��������ķ�����Ϊ0.5NA(NAΪ�����ӵ�����)
A.�٢ڢۢ�B.�ڢۢ�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������������ճ������м�Ϊ�������ᣬ��һ�������£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO+H+ ��H��0��
CH3COO+H+ ��H��0��
��1�����³�ѹ�£���pH=5��ϡ������Һ�У�c(CH3COO��=__������ȷֵ�����з����У�����ʹ0.10mol��L��1CH3COOH�ĵ���̶��������___��
a.��������0.10mol��L1��ϡ���� b.����CH3COOH��Һ c.�������������� d.��ˮϡ����0.010mol��L��1 e.���������Ȼ��ƹ��� f.��������0.10mol��L��1��NaOH��Һ
��2����֪��90��ʱ��ˮ�����ӻ�����ΪKw=38��10��14���ڴ��¶��£���pH=3�������pH=11������������Һ�������ϣ�������Һ�е�c(H+)=___��������λ��Ч���֣���
��3������Ũ�Ⱦ�Ϊ0.1mol/L��������Һ�������� �ڴ��� ���������� ���Ȼ�� �ݴ���� ������� ��������� �ఱˮ����ش��������⣺
��.�١��ڡ��ۡ���������Һ����ˮ�������H����Ũ���ɴ�С��˳����(�����)__��
��.�ܡ��ݡ��ޡ��ߡ���������Һ��NH4+Ũ���ɴ�С��˳����(�����)___��
��4��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣ���������£���a mol/L��CH3COOH��b mol/LBa��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO-�����ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3AsO3)���������ư�Ѫ��������Һ�д��ڶ�������̬����1L0.1mol��L-1H3AsO3��Һ����μ���0.1mol��L-1KOH��Һ�����������ʵ�����������Һ��pH��ϵ��ͼ��ʾ��ͼ��M���Ӧ��pHΪa������˵����ȷ���ǣ� ��
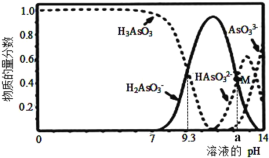
A.H3AsO3�ĵ��볣��Ka1��������Ϊ10-9
B.pH��8.0��10.0ʱ����Ӧ�����ӷ���ʽ��H3AsO3+OH-=H2AsO3-+H2O
C.M���Ӧ����Һ�У�c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol��L-1
D.pH=12 ʱ����Һ�У�c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com