
【题目】下列有关实验原理或操作正确的是

A.洗涤沉淀时(如图2),向漏斗中加适量蒸馏水,搅拌并滤干
B.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
【答案】D
【解析】
A.洗涤沉淀时用玻璃棒引流,注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流走,重复步骤两到三次,不能用玻璃棒搅拌,故A错误;
B.实验室制取二氧化碳可用大理石与稀盐酸在常温下反应,由于二氧化碳密度比空气大,可用向上排空气法收集,可选择图1装置;双氧水在二氧化锰催化作用下制取氧气,选用固液不加热装置,氧气密度比空气大,用向上排空气法收集,可选择图1装置;一氧化氮可以和氧气反应,不能用向上排空气法收集,故B错误;
C.乙醇和水是互溶的,不能用乙醇做碘水分离的萃取剂,故C错误;
D.二氧化硫和与酸性高锰酸发生氧化还原反应,可除去二氧化硫,用浓硫酸干燥可得纯净的二氧化碳气体,故D正确;
故答案为D。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法。化合物F合成路线如下:
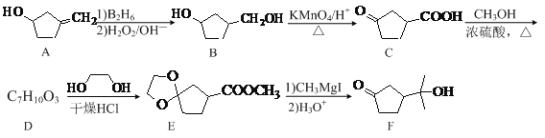
(1)B→C的反应类型为 _______。
(2)C→D反应的化学方程式为________。
(3)从整个流程看,D→E的作用是_______
(4)F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______。
①能与NaHCO3反应产生CO2;
②存在顺反异构体,且至少有6个碳原子共平面;
③核磁共振氢谱图中有5个峰。
(5)写出以CH2=CHCOOH、CH3OH和CH3CH2MgI为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化:造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料-铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:
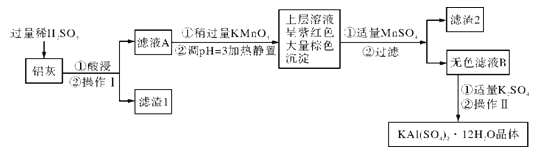
回答下列问题:
(1)明矾净水的原理是_______________(用离子方程式表示)
(2)操作I是__________,操作II是蒸发浓缩、____________、过滤、洗涤、干燥。
(3)将铝灰投入NaOH溶液中生成气体的化学方程式是_____________。在滤液A中加入KMnO4发生反应的离子方程式为_______________。
(4)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为___________________,滤渣2含有的物质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系 ,回答下列问题
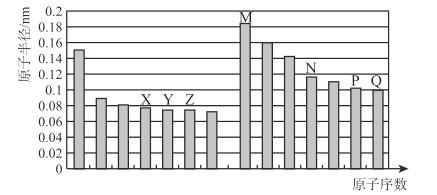
(l)N在周期表中的位置是 _______________。
(2)X、Y、P、Q 四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种的物质是 ______________。
(3)用电子式表示化合物MQ 的形成过程_______________。
(4)Y最高价氧化物对应的水化物的稀溶液与金属 Cu 反应的化学方程式是________。
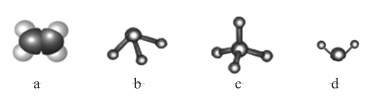
(5)元素 X 和氢元素可以形成多种化合物,下图模型表示的分子中,不可能由 X 和氢元素形成的是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是_______________________。
(2)加入乙醇的作用是_____________________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____________, 该晶体中配体分子的空间构型为_______________________。(用文字描述)
II.含![]() 、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
(1) 在K3[Fe(CN)6]中中心离子是________,配体是_________,配位数是_________。
(2)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:
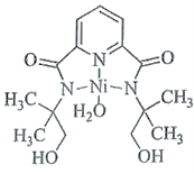
①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键。_____
的配位键。_____
(3) Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为__________________。
(4)![]() 的酸性强于
的酸性强于![]() 的原因是_________________________________________。
的原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液![]() 含Br2的液体
含Br2的液体![]()
![]() 粗溴
粗溴![]() 纯溴
纯溴
B.石英砂![]() 粗硅
粗硅![]() 粗四氯化硅
粗四氯化硅![]() 高纯硅
高纯硅
C.FeS2![]() SO2
SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
D.铝土矿![]() Na[Al(OH)4]溶液
Na[Al(OH)4]溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() 铝
铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同。p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质。这些物质间的转化关系如图所示。下列说法不正确的是
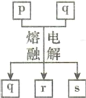
A.原子半径:Y>Z>W>X
B.q属于离子化合物
C.一定条件下,r与s能发生化合反应生成p
D.p能与盐酸反应,但不能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探 究。下列说法不正确的是( )
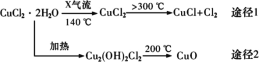
A.途径1中产生的Cl2可以回收循环利用
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X气体是HCl,目的是抑制CuCl22H2O加热过程可能的水解
D.CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu+SO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com