
【题目】利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液![]() 含Br2的液体
含Br2的液体![]()
![]() 粗溴
粗溴![]() 纯溴
纯溴
B.石英砂![]() 粗硅
粗硅![]() 粗四氯化硅
粗四氯化硅![]() 高纯硅
高纯硅
C.FeS2![]() SO2
SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
D.铝土矿![]() Na[Al(OH)4]溶液
Na[Al(OH)4]溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() 铝
铝
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置或操作与实验目的不相符的是
|
|
|
|
A. 证明铜与硝酸的反应 | B. 分离乙醇和乙酸的混合液 | C. 证明氨气易溶于水且水溶液呈碱性 | D. 配制100 mL0.100 mol/LNaCl溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过下列实验探究 KI 与FeCl3溶液的反应,实验过程和现象如下 。
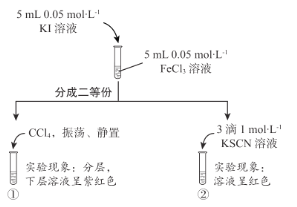
下列说法不正确的是
A.试管①中现象证明有I2生成
B.试管②中现象证明溶液中存在Fe3+
C.KI 与FeCl3溶液的反应方程式为:2Fe3++ 2I-=2Fe2+ + I2
D.综合该实验可推知,Fe3+和I2都具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A.洗涤沉淀时(如图2),向漏斗中加适量蒸馏水,搅拌并滤干
B.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的一组是( )
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③碳原子数不同的直链烷烃一定是同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
A.①②③④B.②③④C.②③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
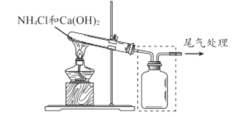
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
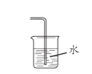
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
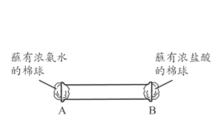
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
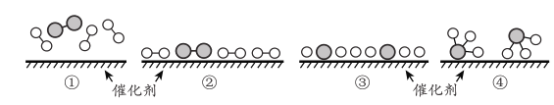
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由电子排布式或排布图所得的结论错误的是( )
选项 | 电子排布式 | 结论 |
A | 1s22s22p | 违背洪特规则 |
B | 1s22s22p63s23p63d3 | 违背能量最低原理 |
C | N的电子排布图: | 违背泡利原理 |
D | 1s22s22p63s23p63d54s1 | 违背能量最低原理 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJ/mol,该反应自发进行的条件为_____。
CH3OH(g) ΔH1,则ΔH1=___kJ/mol,该反应自发进行的条件为_____。
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入1molCO和2.2molH2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
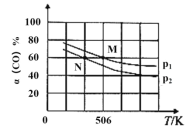
①压强:p1____p2。(填“>”<”或“=”)
②M点时,H2的转化率为_____(计算结果精确到0.1%), 该反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列各项能作为判断该反应达到平衡标志的是______(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
(3)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(NO)/(mol/L) | c(H2)/(mol/L) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_____,n=_____。
②上述反应分两步进行:i.2NO(g)+H2(g)=N2(g)+H2O2(1)(慢反应);ii
A.H2O2是该反应的催化剂 B.反应i的活化能较高
C.总反应速率由反应ii的速率决定 D.反应i中NO和H2的碰撞仅部分有效
(4)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________。
=3,则膜I侧的电极方程式为________。
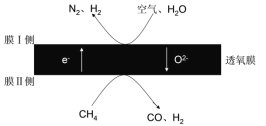
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com