
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
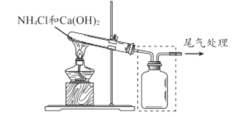
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
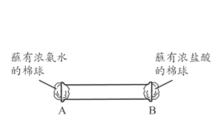
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
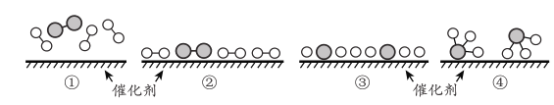
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
【答案】![]()
![]() 氨气极易溶于水,需用防倒吸装置 A、B两端呈白雾,玻璃管中央会产生白烟 向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有
氨气极易溶于水,需用防倒吸装置 A、B两端呈白雾,玻璃管中央会产生白烟 向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有![]() ac
ac
【解析】
(1)上图试管中发生的是实验室制备氨气的反应,其化学方程式为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)由于氨气的密度比空气的小,故需用向下排空气法,采用上图装置收集则需短进长出,故上图方框中补充完整的收集装置如下:![]() ,故答案为:
,故答案为:![]()
(3)由于氨气极易溶于水,故尾气吸收时需防倒吸,故下图设计的尾气处理装置不合理,需接一个倒扣的漏斗,故其理由是氨气极易溶于水,需用防倒吸装置,故答案为:氨气极易溶于水,需用防倒吸装置;
(4) 由于浓氨水和浓盐酸都有很强的挥发性,挥发出来的NH3和HCl在玻璃管的中央发生反应:NH3+HCl=NH4Cl,产生NH4Cl固体小颗粒,故形成白烟,可观察到的现象是A、B两端呈白雾,玻璃管中央会产生白烟,故答案为:A、B两端呈白雾,玻璃管中央会产生白烟;
(5)将上图反应后试管中固体可能含有过量的NH4Cl,实验室检验![]() 的方法为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有
的方法为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有![]() ,故答案为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有
,故答案为:向a溶液中加入强碱NaOH溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有![]() ;
;
(6) a.使用催化剂,降低反应所需要的活化能,可以加快合成氨的反应速率,a正确;
b.断裂化学键均需吸收能量,故②→③过程,是吸热过程,但包括H - H 键和N≡N键的断裂,b错误;
c.由图中可知,不同非金属原子之间形成的共价键是极性共价键,故③→④过程,N 原 子和 H 原子形成了含有极性键的NH3,c正确;
d.合成氨反应是放热反应,故反应物断键吸收能量小于生成物形成新键释放的能量,d错误;
故答案为:ac。


科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
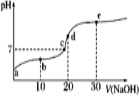
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化:造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料-铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:
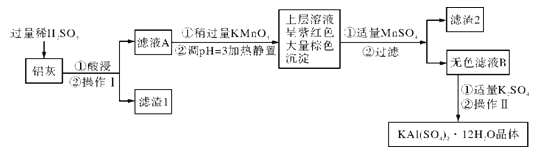
回答下列问题:
(1)明矾净水的原理是_______________(用离子方程式表示)
(2)操作I是__________,操作II是蒸发浓缩、____________、过滤、洗涤、干燥。
(3)将铝灰投入NaOH溶液中生成气体的化学方程式是_____________。在滤液A中加入KMnO4发生反应的离子方程式为_______________。
(4)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为___________________,滤渣2含有的物质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是_______________________。
(2)加入乙醇的作用是_____________________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____________, 该晶体中配体分子的空间构型为_______________________。(用文字描述)
II.含![]() 、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
(1) 在K3[Fe(CN)6]中中心离子是________,配体是_________,配位数是_________。
(2)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:
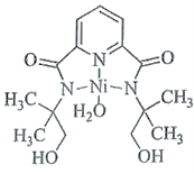
①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键。_____
的配位键。_____
(3) Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为__________________。
(4)![]() 的酸性强于
的酸性强于![]() 的原因是_________________________________________。
的原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液![]() 含Br2的液体
含Br2的液体![]()
![]() 粗溴
粗溴![]() 纯溴
纯溴
B.石英砂![]() 粗硅
粗硅![]() 粗四氯化硅
粗四氯化硅![]() 高纯硅
高纯硅
C.FeS2![]() SO2
SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
D.铝土矿![]() Na[Al(OH)4]溶液
Na[Al(OH)4]溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() 铝
铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
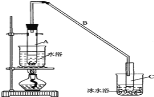
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: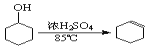 +H2O
+H2O
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__,导管B除了导气外还具有的作用是__。
②试管C置于冰水浴中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在__层(填“上”或“下”),分液后用__(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②如再将环己烯进行蒸馏,冷却水应从__口进入(填“上”或“下”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同。p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质。这些物质间的转化关系如图所示。下列说法不正确的是
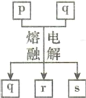
A.原子半径:Y>Z>W>X
B.q属于离子化合物
C.一定条件下,r与s能发生化合反应生成p
D.p能与盐酸反应,但不能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较卤素单质的氧化性进行以下实验:①将新制氯水滴入溴化钠溶液中,溶液变黄色;②将新制氯水滴入碘化钾溶液中,溶液变褐色。下列有关说法不合理的是( )
A.①中发生的离子反应为![]()
B.向②所得溶液中再加入![]() 振荡,静默,下层溶液呈紫红色
振荡,静默,下层溶液呈紫红色
C.将①、②可得出结论:氧化性![]()
D.将②中新制氯水换成溴水,若实验现象相同,即可得出氧化性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某物理研究所研制出由![]() 构成的单质气体
构成的单质气体![]() ,已知
,已知![]() 是一种稳定的核素。下列有关说法不正确的是( )
是一种稳定的核素。下列有关说法不正确的是( )
A.![]() 的摩尔质量为
的摩尔质量为![]()
B.![]()
![]() 中所含的中子数为
中所含的中子数为![]()
C.![]()
![]() 的体积为
的体积为![]()
D.![]()
![]() 的物质的量为
的物质的量为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com