
【题目】我国某物理研究所研制出由![]() 构成的单质气体
构成的单质气体![]() ,已知
,已知![]() 是一种稳定的核素。下列有关说法不正确的是( )
是一种稳定的核素。下列有关说法不正确的是( )
A.![]() 的摩尔质量为
的摩尔质量为![]()
B.![]()
![]() 中所含的中子数为
中所含的中子数为![]()
C.![]()
![]() 的体积为
的体积为![]()
D.![]()
![]() 的物质的量为
的物质的量为![]()
科目:高中化学 来源: 题型:
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
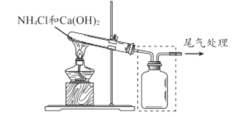
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
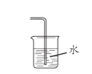
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
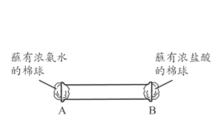
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
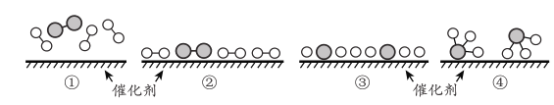
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成了一种能自动愈合自身内部细微裂纹的神奇塑料,合成路线如图所示:
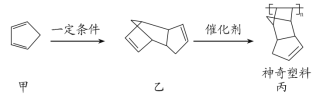
下列说法正确的是( )
A.甲的化学名称为2,4-环戊二烯
B.一定条件下,1mol乙与1molH2加成的产物可能为![]()
C.若神奇塑料的平均相对分子质量为10000,则其平均聚合度约为90
D.甲的所有链状不饱和烃稳定结构的同分异构体有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:
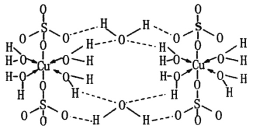
下列有关胆矾的说法正确的是
A.Cu2+的价电子排布式为3d84s1
B.所有氧原子都采取sp3杂化
C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键
D.胆矾所含元素中,H、O、S的半径及电负性依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJ/mol,该反应自发进行的条件为_____。
CH3OH(g) ΔH1,则ΔH1=___kJ/mol,该反应自发进行的条件为_____。
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入1molCO和2.2molH2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
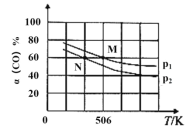
①压强:p1____p2。(填“>”<”或“=”)
②M点时,H2的转化率为_____(计算结果精确到0.1%), 该反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列各项能作为判断该反应达到平衡标志的是______(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
(3)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(NO)/(mol/L) | c(H2)/(mol/L) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_____,n=_____。
②上述反应分两步进行:i.2NO(g)+H2(g)=N2(g)+H2O2(1)(慢反应);ii
A.H2O2是该反应的催化剂 B.反应i的活化能较高
C.总反应速率由反应ii的速率决定 D.反应i中NO和H2的碰撞仅部分有效
(4)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________。
=3,则膜I侧的电极方程式为________。
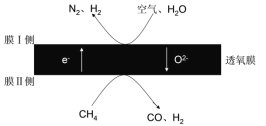
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
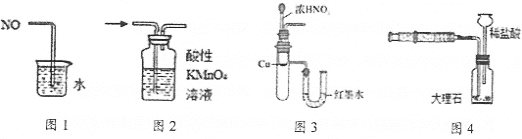
A.图1可用于吸收多余的NO
B.图2可用于检验SO2的漂白性
C.图3可用于说明铜与浓硝酸反应的能量变化
D.图4可用于测定CO2的生成速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。如图为实绘室制备溴乙烷的装置示意图(夹持仅器已略去)。G中盛蒸馏水,实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。实验室制备溴乙烷的反应原理如下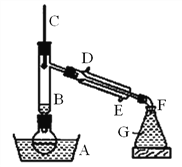
NaBr+H2SO4(浓)![]() NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
己知药品的用量:①NaBr(s)0.3mol,②浓硫酸36mL(98%、密度1.84g/cm3),③乙醇0.25mol。
可能存在的副反应有:醇在浓硫酸存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。试问答:
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需加入适量的______。
(2)装置B的作用是:①使溴乙烷馏出,②_________。
(3)溴乙烷可用水下收集法的依据是______、_______。
(4)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为____(填编号)。
a.碘化钾溶液b.亚硫酸氢钠溶液c.氢氧化钠溶液
(5)本实验的产率为60%,则可制取溴乙烷______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为![]() 其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.
其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.![]() 与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是
与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是![]()
A.W的离子半径![]() 的离子半径
的离子半径
B.Z的氢化物稳定性![]() 的氢化物稳定性
的氢化物稳定性
C.Y的氧化物既能与盐酸,又能与NaOH溶液反应
D.![]() 、
、![]() 两种化合物含有的化学键类型完全相同
两种化合物含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
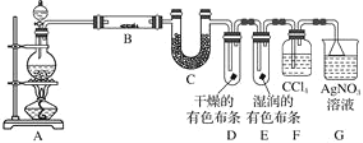
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com