
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。如图为实绘室制备溴乙烷的装置示意图(夹持仅器已略去)。G中盛蒸馏水,实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。实验室制备溴乙烷的反应原理如下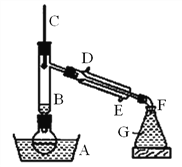
NaBr+H2SO4(浓)![]() NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
己知药品的用量:①NaBr(s)0.3mol,②浓硫酸36mL(98%、密度1.84g/cm3),③乙醇0.25mol。
可能存在的副反应有:醇在浓硫酸存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。试问答:
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需加入适量的______。
(2)装置B的作用是:①使溴乙烷馏出,②_________。
(3)溴乙烷可用水下收集法的依据是______、_______。
(4)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为____(填编号)。
a.碘化钾溶液b.亚硫酸氢钠溶液c.氢氧化钠溶液
(5)本实验的产率为60%,则可制取溴乙烷______g。
【答案】 水 使沸点高于溴乙烷的物质回流 溴乙烷为有机物 密度比水大且难溶于水 b 16.4
【解析】(1)浓硫酸具有强氧化性,易与NaBr发生氧化还原反应,可能发生的副反应有:2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O,为减少副反应发生,可先加水稀释,防止HBr被氧化;
Br2+SO2↑+2H2O,为减少副反应发生,可先加水稀释,防止HBr被氧化;
(2)装置B的作用,可起到与空气充分热交换的作用,使蒸汽充分冷凝,;
(3)溴乙烷可用水下收集法的依据是,溴乙烷为有机物,密度比水大且难溶于水,水封,防止蒸气逸出,并防止倒吸;
(4)粗产品用水洗涤后有机层仍呈红棕色,是由于溴乙烷溶解了Br2的缘故,可用亚硫酸氢钠溶液洗涤除去,采用亚硫酸氢钠溶液,不用氢氧化钠,是为了防止C2H5Br的水解,故答案为B;
(5)n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,m(溴乙烷)=0.15mol×109g/mol=16.4g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同。p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质。这些物质间的转化关系如图所示。下列说法不正确的是
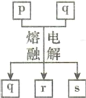
A.原子半径:Y>Z>W>X
B.q属于离子化合物
C.一定条件下,r与s能发生化合反应生成p
D.p能与盐酸反应,但不能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探 究。下列说法不正确的是( )
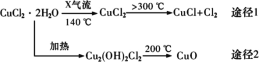
A.途径1中产生的Cl2可以回收循环利用
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X气体是HCl,目的是抑制CuCl22H2O加热过程可能的水解
D.CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某物理研究所研制出由![]() 构成的单质气体
构成的单质气体![]() ,已知
,已知![]() 是一种稳定的核素。下列有关说法不正确的是( )
是一种稳定的核素。下列有关说法不正确的是( )
A.![]() 的摩尔质量为
的摩尔质量为![]()
B.![]()
![]() 中所含的中子数为
中所含的中子数为![]()
C.![]()
![]() 的体积为
的体积为![]()
D.![]()
![]() 的物质的量为
的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数为X最外层电子数的一半,X、Y、Z的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2的结构式为Y≡X—Z—Z—X≡Y。下列说法正确的是
A.(XY)2中X元素的化合价为+3
B.Y的氧化物对应的水化物是强酸
C.化合物W(Y3)2中只含有离子键
D.X和Z组成的化合物中不可能所有原子都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
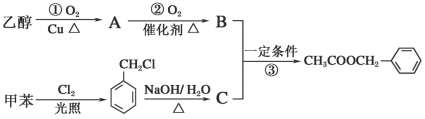
(1)写出反应①的化学方程_____________________________。
(2)反应③的反应类型为________________________。
(3)C的结构简式为______________________________。
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)______________、______________。
(5)反应_________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)CH4既是一种重要的能源,也是一种重要的化工原料。已知 8.0 g CH4完全燃烧生成液态水放出445.15 kJ热量,则其热化学方程式为_____。
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____左右。
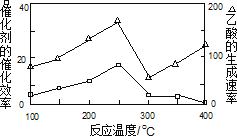
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_____。
③CH4 还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为 N2和O2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为_____。
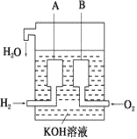
(3)美国阿波罗宇宙飞船上使用了一种新型电池装置,其构造如下图所示,A、B两个电极均由多孔的炭块组成。该电池的负极反应式为:_____。
若该电池工作时增加了1 mol H2O,电路中转移电子的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
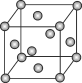
(1)钼晶体的堆积方式为_______________,晶体中粒子的配位数为________________。
(2)构成钼晶体的粒子是________(填“原子”,“分子”或“离子”),晶胞中所含的该种粒子数为___________。
(3)金属钼的密度为______________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com