
【题目】I.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是_______________________。
(2)加入乙醇的作用是_____________________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____________, 该晶体中配体分子的空间构型为_______________________。(用文字描述)
II.含![]() 、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
(1) 在K3[Fe(CN)6]中中心离子是________,配体是_________,配位数是_________。
(2)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:
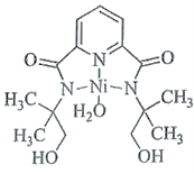
①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键。_____
的配位键。_____
(3) Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为__________________。
(4)![]() 的酸性强于
的酸性强于![]() 的原因是_________________________________________。
的原因是_________________________________________。
【答案】[Cu(H2O)4]2+ 降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度 Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH- 配位键(或共价健) 三角锥形 Fe3+ CN— 6 ![]()
![]()
 As>Se>Ge
As>Se>Ge ![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强
酸性更强
【解析】
I.由信息可知,溶于水后加氨水发生Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,再加入乙醇溶剂,将析出深蓝色的晶体为Cu(NH3)4SO4H2O。
II.(1)根据配合物K3[Fe(CN)6结构分析,含有空轨道的金属阳离子为中心离子,有孤对电子的原子或离子为配体,配位数就是配体的个数;
(2)根据结构式可知,N原子价电子对数为3、4,所以杂化方式为sp2、sp3;N、O提供孤电子对;
(3)同周期,从左到右,第一电离能增大,As的价电子排布式为:4s24p3,p轨道半充满状态,较稳定,第一电离能最大,据此判断第一电离能大小;
(4)![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多或
多或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,据此判断酸性强弱。
中的O的电子向As偏移,据此判断酸性强弱。
I.(1)溶液中呈天蓝色微粒的化学式是[Cu(NH3)4]2+,故答案为:[Cu(NH3)4]2+;
(2)加入乙醇的作用是降低溶剂的极性,减小Cu(NH3)4SO4H2O的溶解度,故答案为:降低溶剂的极性,减小Cu(NH3)4SO4H2O的溶解度;
(3)蓝色沉淀溶解成深蓝色溶液的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(4)Cu(NH3)4SO4H2O中Cu2+与NH3之间的化学键由Cu2+提供空轨道,N原子提供电子对,为配位键(或共价健);配体分子为氨,空间构型为三角锥形,故答案为:配位键(或共价健);三角锥形。
II.(1)根据配合物K3[Fe(CN)6结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Fe3+、有孤对电子的原子或离子为配体,所以配体为CN、配位数就是配体的个数,所以配位数为6,故答案为:Fe3+;CN;6;
(2)①价电子对数=![]() 键+孤电子对数,根据结构式可知,N原子的价电子对数为:3、4,其杂化方式为sp2、sp3,故答案为:sp2;sp3;
键+孤电子对数,根据结构式可知,N原子的价电子对数为:3、4,其杂化方式为sp2、sp3,故答案为:sp2;sp3;
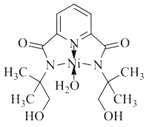
②N、O提供孤电子对,所以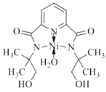 ,故答案为:
,故答案为: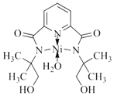 ;
;
(3)同周期,从左到右,第一电离能增大,As的价电子排布式为:4s24p3,p轨道半充满状态,较稳定,第一电离能最大,则第一电离能为:As>Se>Ge,故答案为:As>Se>Ge;
(4)![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强或
的酸性强或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强,故答案为:
酸性更强,故答案为:![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强。
酸性更强。


科目:高中化学 来源: 题型:
【题目】硅酸钠被列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程简图:
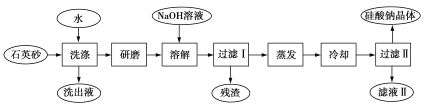
(1)要将洗出液中的溶质析出,采用的方法是蒸发结晶,则蒸发时用到的主要仪器有______。
(2)图中加入NaOH溶液,发生反应的离子方程式为______。
(3)洗涤石英砂的目的是______,过滤Ⅰ所得残渣为______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨(![]() )、镆(
)、镆(![]() )、(
)、(![]() )、(
)、(![]() )。已知第113号元素与
)。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第VB族
在元素周期表中的位置是第7周期第VB族
C.![]() 的非金属性比I的弱
的非金属性比I的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A.洗涤沉淀时(如图2),向漏斗中加适量蒸馏水,搅拌并滤干
B.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料。结合以下路线回答下列问题。
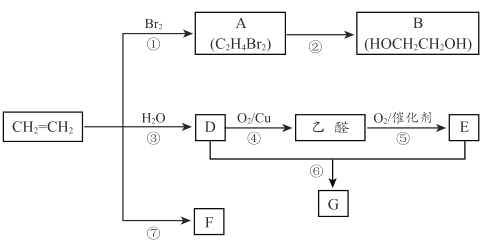
(1)反应①的化学方程式是 ____________________。
(2)B的官能团是_______________。
(3)反应④的化学方程式是_________________。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F 的结构简式是__________。
(5)E的分子式是 C2H4O2能使紫色石蕊试液变红; G 是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取 G, 装置如图所示。
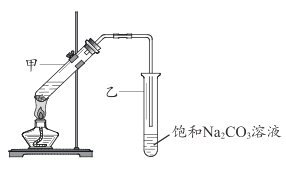
i.甲试管中反应的化学方程式是 __________;反应类型是_________。
ii.分离出试管乙中油状液体用到的主要仪器是___________________。
iii.如果将 4. 6g D 和 3g E 在催化剂条件下发生上述反应 ,充分反应后,如果实际产率为60%,实际得到G 的质量是__________ g。(已知:实际产率= 实际得到质量/理论计算质量)
(6)丙烯( CH3CH = CH2 ) 与乙烯互为同系物,在催化剂、加热条件下与O2 反应生成一种重要的化工原料丙烯酸( CH2= CHCOOH )。下列关于丙烯酸的说法正确的是 ________。
a.与乙酸互为同系物
b.能发生加成、酯化、氧化反应
c.能与 NaHCO3溶液反应生成 CO2
d.一定条件下能发生加聚反应,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
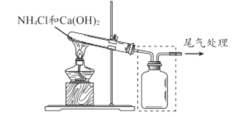
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
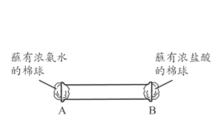
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
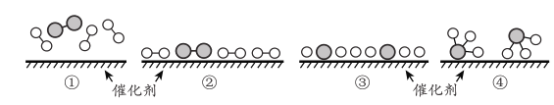
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:
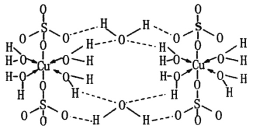
下列有关胆矾的说法正确的是
A.Cu2+的价电子排布式为3d84s1
B.所有氧原子都采取sp3杂化
C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键
D.胆矾所含元素中,H、O、S的半径及电负性依次增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com