
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨(![]() )、镆(
)、镆(![]() )、(
)、(![]() )、(
)、(![]() )。已知第113号元素与
)。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第VB族
在元素周期表中的位置是第7周期第VB族
C.![]() 的非金属性比I的弱
的非金属性比I的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
【答案】C
【解析】
A. Nh与Al同主族,同主族元素从上到下金属性逐渐增强,Al(OH)3是两性氢氧化物,则Nh的最高价氧化物对应的水化物Nh(OH)3是一种强碱,不具有两性,故A错误;
B. 第113号元素与Al元素同主族,则115号元素Mc在元素周期表中的位置是第七周期第ⅤA族,故B错误;
C. 第113号元素与Al元素同主族,则117号元素Ts位于第7周期第ⅦA族,同主族元素从上到下非金属性逐渐减弱,故Ts的非金属性比I的弱,故C正确;
D. 第113号元素与Al元素同主族,则118号元素Og为第7周期0族元素,最外层为8电子稳定结构,性质稳定,不具有较强的非金属性,故D错误;
故选C。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
(1)氯化铝是____________。(填“离子化合物”或“共价化合物”)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈的“发烟”,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
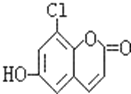
A.2molBr2、2molNaOHB.3molBr2、4molNaOH
C.3molBr2、5molNaOHD.4molBr2、5molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空:
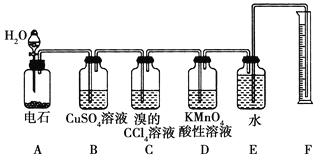
(1)实验室制乙炔的化学方程式是____________________________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用________________来代替水。
(2)装置B中CuSO4溶液的作用是________________。
(3)装置C中观察到的现象是_________________,反应的化学方程式是___________________。
(4)装置D中观察到的现象是_________________,该反应的类型是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化:造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料-铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:
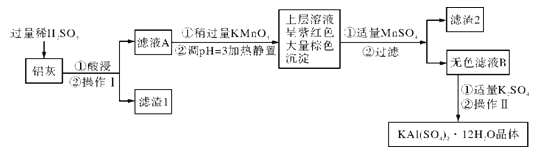
回答下列问题:
(1)明矾净水的原理是_______________(用离子方程式表示)
(2)操作I是__________,操作II是蒸发浓缩、____________、过滤、洗涤、干燥。
(3)将铝灰投入NaOH溶液中生成气体的化学方程式是_____________。在滤液A中加入KMnO4发生反应的离子方程式为_______________。
(4)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为___________________,滤渣2含有的物质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是_______________________。
(2)加入乙醇的作用是_____________________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____________, 该晶体中配体分子的空间构型为_______________________。(用文字描述)
II.含![]() 、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
、Fe元素的物质在生产生活中有重要的用途。回答下列问题:
(1) 在K3[Fe(CN)6]中中心离子是________,配体是_________,配位数是_________。
(2)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:
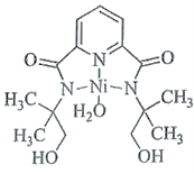
①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键。_____
的配位键。_____
(3) Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为__________________。
(4)![]() 的酸性强于
的酸性强于![]() 的原因是_________________________________________。
的原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
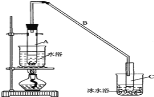
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: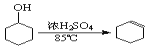 +H2O
+H2O
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__,导管B除了导气外还具有的作用是__。
②试管C置于冰水浴中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在__层(填“上”或“下”),分液后用__(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②如再将环己烯进行蒸馏,冷却水应从__口进入(填“上”或“下”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
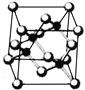
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________, Cu2+的核外电子排布式为_______________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________和_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com