
【题目】实验室用如图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空:
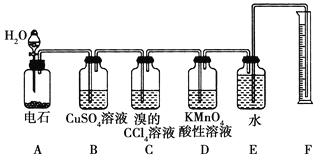
(1)实验室制乙炔的化学方程式是____________________________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用________________来代替水。
(2)装置B中CuSO4溶液的作用是________________。
(3)装置C中观察到的现象是_________________,反应的化学方程式是___________________。
(4)装置D中观察到的现象是_________________,该反应的类型是______________。
【答案】CaC2+2H2O→HC≡CH↑+Ca(OH)2 饱和食盐水 除去H2S杂质,以防干扰后续实验 溶液褪色 2Br2+HC≡CH→CHBr2—CHBr2 紫色褪去 氧化反应
【解析】
(1)实验室制备乙炔是利用电石和水反应生成乙炔和氢氧化钙,反应的化学方程式为CaC2+2H2O→HC≡CH↑+Ca(OH)2,电石与水反应剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的乙炔气流,可用饱和食盐水代替水。
(2)硫化氢气体具有还原性,也会导致溴的四氯化碳、高锰酸钾酸性溶液褪色,装置B中CuSO4溶液的作用是除去乙炔中的硫化氢:Cu2++H2S==CuS↓+2H+,防止干扰后续检验实验。
(3)乙炔气体通过溴的四氯化碳溶液,会发生加成反应,装置C中观察到的现象是溶液褪色,反应的化学方程式为2Br2+HC≡CH→CHBr2-CHBr2。
(4)乙炔通过高锰酸钾酸性溶液,乙炔含有不饱和键,被高锰酸钾酸性溶液氧化生成二氧化碳,装置D中观察到的现象是溶液褪色,发生的反应为氧化反应。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。回答下 列问题:
(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。(CN)2 中π键和σ键的数目之比为__________。沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)mROn,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H+。酸性强弱:HNO2____________HNO3(填“大于”、“等于”或“小于”);NO2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。

已知正六棱柱的边长为 a cm,高为 b cm,NA 表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3(用含 NA、a、b 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸及其盐的叙述不正确的是( )
A.硅酸是一种弱酸,可由其酸性氧化物![]() 与水化合而制得
与水化合而制得
B.硅酸盐是构成地壳中岩石的主要成分,黏土的主要成分是硅酸盐
C.陶瓷材料是人类应用最早的硅酸盐材料
D.高温结构陶瓷、生物陶瓷是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
B.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.Al![]() NaAlO2
NaAlO2![]() AlCl3溶液
AlCl3溶液![]() 无水AlCl3
无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨(![]() )、镆(
)、镆(![]() )、(
)、(![]() )、(
)、(![]() )。已知第113号元素与
)。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第VB族
在元素周期表中的位置是第7周期第VB族
C.![]() 的非金属性比I的弱
的非金属性比I的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料。结合以下路线回答下列问题。
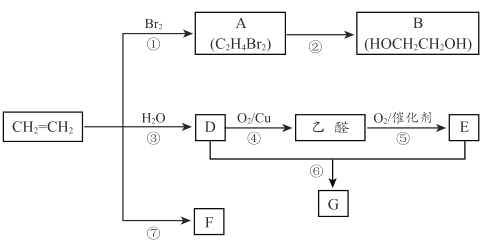
(1)反应①的化学方程式是 ____________________。
(2)B的官能团是_______________。
(3)反应④的化学方程式是_________________。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F 的结构简式是__________。
(5)E的分子式是 C2H4O2能使紫色石蕊试液变红; G 是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取 G, 装置如图所示。
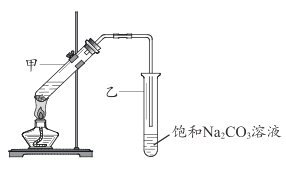
i.甲试管中反应的化学方程式是 __________;反应类型是_________。
ii.分离出试管乙中油状液体用到的主要仪器是___________________。
iii.如果将 4. 6g D 和 3g E 在催化剂条件下发生上述反应 ,充分反应后,如果实际产率为60%,实际得到G 的质量是__________ g。(已知:实际产率= 实际得到质量/理论计算质量)
(6)丙烯( CH3CH = CH2 ) 与乙烯互为同系物,在催化剂、加热条件下与O2 反应生成一种重要的化工原料丙烯酸( CH2= CHCOOH )。下列关于丙烯酸的说法正确的是 ________。
a.与乙酸互为同系物
b.能发生加成、酯化、氧化反应
c.能与 NaHCO3溶液反应生成 CO2
d.一定条件下能发生加聚反应,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
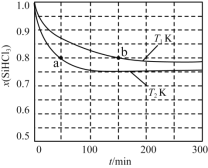
A. 该反应为放热反应,v正,a<v逆,b
B. 化学平衡状态时2v消耗(SiHCl3)=v消耗(SiCl4)
C. 当反应进行到a处时,v正/v逆=16/9
D. T2 K时平衡体系中再充入1 mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com