
【题目】碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。回答下 列问题:
(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。(CN)2 中π键和σ键的数目之比为__________。沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)mROn,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H+。酸性强弱:HNO2____________HNO3(填“大于”、“等于”或“小于”);NO2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。

已知正六棱柱的边长为 a cm,高为 b cm,NA 表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3(用含 NA、a、b 的式子表示)。
【答案】4:3 小于 (CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低 小于 sp2杂化 ![]()
【解析】
(1)(CN)2的结构式为![]() ,单键是σ键,三键中有1个σ键和2个π键,以此分析;分子晶体相对分子质量越大,范德华力越大,沸点越高;
,单键是σ键,三键中有1个σ键和2个π键,以此分析;分子晶体相对分子质量越大,范德华力越大,沸点越高;
(2)HNO2可变形为:HONO,HNO3可变形为:HONO2,再根据题意分析;利用价层电子对互斥理论来分析判断NO2-中氮原子的杂化方式;
(3)利用均摊法计算晶胞中Se原子,注意顶点原子为6个晶胞共用;根据![]() 计算。
计算。
(1)(CN)2的结构式为![]() ,单键是σ键,三键中有1个σ键和2个π键,(CN)2 中π键和σ键的数目之比为4:3;(CN)2与(SCN)2均为分子晶体,且分子间不存在氢键,(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低,故答案为:4:3;小于;(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低;
,单键是σ键,三键中有1个σ键和2个π键,(CN)2 中π键和σ键的数目之比为4:3;(CN)2与(SCN)2均为分子晶体,且分子间不存在氢键,(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低,故答案为:4:3;小于;(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低;
(2)HNO2可变形为:HONO,HNO3可变形为:HONO2,则硝酸中n=2大于亚硝酸中n=1,酸性HNO2小于HNO3;NO2-中氮原子价层电子对数为![]() ,则NO2-中氮原子的杂化方式为sp2杂化,故答案为:小于;sp2杂化;
,则NO2-中氮原子的杂化方式为sp2杂化,故答案为:小于;sp2杂化;
(3)Se原子间形成正六棱柱,位于面心与顶点,从晶胞的俯视图可知晶胞中Se原子数目为![]() ,晶胞质量为
,晶胞质量为![]() ,晶胞的体积
,晶胞的体积![]() ,密度
,密度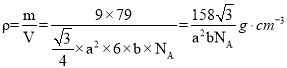 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。
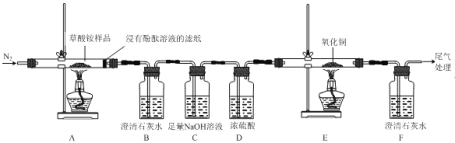
(1)实验证明草酸铵分解产物有:NH3、CO2、CO和水,其中说明分解产物中有CO的实验现象是__。
(2)装置C中发生反应的离子方程式为_____。
Ⅱ.该同学利用草酸铵测定某品牌牛奶中钙的含量,实验步骤如下:
①取100 mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.100mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗KMnO4溶液16.00mL。
已知:H++![]() +H2C2O4——Mn2++CO2+H2O(未配平)
+H2C2O4——Mn2++CO2+H2O(未配平)
(3)计算该品牌牛奶中钙的含量(单位:g·L-1),写出计算过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
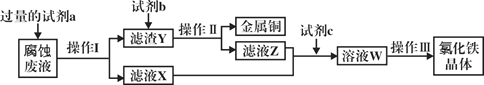
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的基本化工原料,可用于生产聚乙烯、乙醇等。
(1)工业上乙烯主要是由石油加工得到,由石油制得乙烯的方法是 __________(填序号)。
a.分馏 b.裂化 c.裂解 d.干馏
(2)聚乙烯是一种用途广泛的塑料,由乙烯制取聚乙烯的化学方程式:___________。
(3)在工业上,乙醇可由乙烯与水发生加成反应制得,其反应的化学方程式__________。
(4)某烯烃 A 进行如下反应,A、D 所有碳原子处于同一平面,D、E 互为同分异构体。
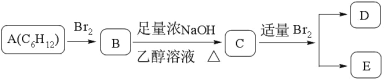
①A 的结构简式为___________。
②B 生成 C 的化学方程式为__________, 反应类型为___________。
③C 生成 D 的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二元化合物X可由单质硫和Ca(OH)2浊液共热制得。取一定量X与100 mL 0.2 mol·L1稀硫酸恰好完全反应,生成0.08 mol淡黄色沉淀和0.448 L气体甲(已折算为标准状况)。请回答:
(1) 甲的电子式为________。
(2) X的化学式为________。
(3) X与稀硫酸反应的化学方程式为________。
(4) 单质硫和Ca(OH)2浊液制X时,还生成另一种含氧酸盐(M<160 g·mol 1),该盐与稀硫酸反应也有淡黄色沉淀生成并放出刺激性气味气体,则单质硫与Ca(OH)2浊液反应制X的化学方程式为________。
(5) 气体甲通入硫酸铁溶液中能发生反应。请设计实验方案验证反应后溶液中除H+之外的阳离子________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.202×l05Pa),但它在180℃即开始升华。
(1)氯化铝是____________。(填“离子化合物”或“共价化合物”)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈的“发烟”,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空:
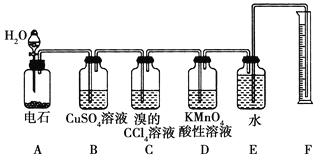
(1)实验室制乙炔的化学方程式是____________________________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用________________来代替水。
(2)装置B中CuSO4溶液的作用是________________。
(3)装置C中观察到的现象是_________________,反应的化学方程式是___________________。
(4)装置D中观察到的现象是_________________,该反应的类型是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com