
【题目】下列反应属于加成反应的是
A.乙烯与氢气反应生成乙烷B.乙醇与钠反应生成乙醇钠
C.甲烷与氯气反应生成一氯甲烷D.乙酸与乙醇反应生成乙酸乙酯
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】已知1~20号元素中![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的质子数大小顺序为
四种元素原子的质子数大小顺序为![]() ;
;![]() 元素原子的最外层电子数是次外层电子数的2倍;
元素原子的最外层电子数是次外层电子数的2倍;![]() 元素原子的
元素原子的![]() 层电子数是
层电子数是![]() 层电子数的一半;
层电子数的一半;![]() 元素原子的次外层电子数比最外层电子数多1;
元素原子的次外层电子数比最外层电子数多1;![]() 元素原子的
元素原子的![]() 层、
层、![]() 层电子数之和等于
层电子数之和等于![]() 层、
层、![]() 层电子数之和。试推断:
层电子数之和。试推断:
(1)元素的名称:![]() ______,
______,![]() ______。
______。
(2)原子结构示意图:![]() ______,
______,![]() ______。
______。
(3)实验室制取![]() 的单质的化学方程式为______。
的单质的化学方程式为______。
(4)若没有“质子数大小顺序为![]() ”的限制,
”的限制,![]() 还可以是______元素。
还可以是______元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。回答下 列问题:
(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。(CN)2 中π键和σ键的数目之比为__________。沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)mROn,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H+。酸性强弱:HNO2____________HNO3(填“大于”、“等于”或“小于”);NO2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。

已知正六棱柱的边长为 a cm,高为 b cm,NA 表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3(用含 NA、a、b 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
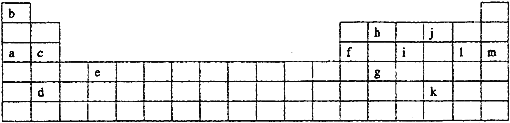
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________;
(2)表中X可能为以上13种元素中的______(填写字母)元素。用元素符号表示X和j形成化合物的化学式________;
(3)Y是周期表中_______族元素;
(4)以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸钠被列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程简图:
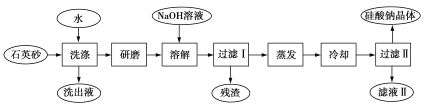
(1)要将洗出液中的溶质析出,采用的方法是蒸发结晶,则蒸发时用到的主要仪器有______。
(2)图中加入NaOH溶液,发生反应的离子方程式为______。
(3)洗涤石英砂的目的是______,过滤Ⅰ所得残渣为______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有_________个;
每个Na+离子周围与它最接近的、且距离相等的Na+共有__________个。而Na+离子数目与Cl-离子数目之比为______________。
在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。

试回答下列问题:
(2)NaCl晶体中离子键的键长为______________________。Na+离子半径与Cl-离子半径比r+/r- =____________。(已知 √2=1.414 , √3=1.732, √5=2.236)
(3)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为_______________________。
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸及其盐的叙述不正确的是( )
A.硅酸是一种弱酸,可由其酸性氧化物![]() 与水化合而制得
与水化合而制得
B.硅酸盐是构成地壳中岩石的主要成分,黏土的主要成分是硅酸盐
C.陶瓷材料是人类应用最早的硅酸盐材料
D.高温结构陶瓷、生物陶瓷是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
B.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.Al![]() NaAlO2
NaAlO2![]() AlCl3溶液
AlCl3溶液![]() 无水AlCl3
无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料。结合以下路线回答下列问题。
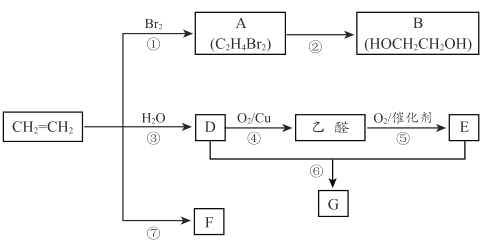
(1)反应①的化学方程式是 ____________________。
(2)B的官能团是_______________。
(3)反应④的化学方程式是_________________。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F 的结构简式是__________。
(5)E的分子式是 C2H4O2能使紫色石蕊试液变红; G 是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取 G, 装置如图所示。
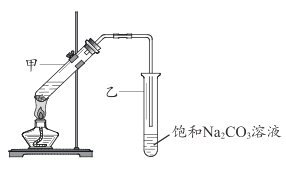
i.甲试管中反应的化学方程式是 __________;反应类型是_________。
ii.分离出试管乙中油状液体用到的主要仪器是___________________。
iii.如果将 4. 6g D 和 3g E 在催化剂条件下发生上述反应 ,充分反应后,如果实际产率为60%,实际得到G 的质量是__________ g。(已知:实际产率= 实际得到质量/理论计算质量)
(6)丙烯( CH3CH = CH2 ) 与乙烯互为同系物,在催化剂、加热条件下与O2 反应生成一种重要的化工原料丙烯酸( CH2= CHCOOH )。下列关于丙烯酸的说法正确的是 ________。
a.与乙酸互为同系物
b.能发生加成、酯化、氧化反应
c.能与 NaHCO3溶液反应生成 CO2
d.一定条件下能发生加聚反应,生成![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com