
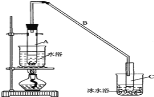
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: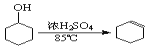 +H2O
+H2O
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__,导管B除了导气外还具有的作用是__。
②试管C置于冰水浴中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在__层(填“上”或“下”),分液后用__(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②如再将环己烯进行蒸馏,冷却水应从__口进入(填“上”或“下”)。
【答案】防止暴沸 冷凝 进一步冷却,防止环己烯挥发 上层 C 下
【解析】
环己醇在浓硫酸做催化剂的条件下加热,发生消去反应生成环己烯,产物中会有少量的环己醇和少量酸性杂质,利用环己烯不溶于水、与碳酸钠溶液不反应的性质,可以用饱和碳酸钠溶液进行洗涤;由于环己烯密度比水小、易挥发,在收集产物时,可以在低温下进行。
(1)①碎瓷片在反应中主要是起到防止暴沸的作用,长导管B除了能起到导气的作用还起到冷凝的作用。
故答案为:防止爆沸;冷凝回流。
②根据图表信息可知,环己烯易挥发,因此试管C置于冰水浴中的目的是防止环己烯挥发。
故答案为:防止环己烯挥发。
(2)①环己烯的密度比饱和食盐水的密度小,不溶于水,因此环己烯在上层;环己烯粗品中含有环己醇和少量酸性杂质由于乙醇溶解在碳酸钠溶液中,酸可以与碳酸钠反应,而环己烯不能与碳酸钠反应,因此可用饱和碳酸钠溶液进行洗涤。而酸性高锰酸钾溶液能够氧化环己烯,不能选用,硫酸与酸不反应,不能选用;
故答案为:上层;C。
②为达到较好的冷凝效果,冷凝管水的流向是下进上出,因此冷却水应从下口进入。
故答案为:下。


科目:高中化学 来源: 题型:
【题目】下列关于硅酸及其盐的叙述不正确的是( )
A.硅酸是一种弱酸,可由其酸性氧化物![]() 与水化合而制得
与水化合而制得
B.硅酸盐是构成地壳中岩石的主要成分,黏土的主要成分是硅酸盐
C.陶瓷材料是人类应用最早的硅酸盐材料
D.高温结构陶瓷、生物陶瓷是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨(![]() )、镆(
)、镆(![]() )、(
)、(![]() )、(
)、(![]() )。已知第113号元素与
)。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
元素同主族,根据元素周期律的知识,下列预测或说法合理的是( )
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第VB族
在元素周期表中的位置是第7周期第VB族
C.![]() 的非金属性比I的弱
的非金属性比I的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料。结合以下路线回答下列问题。
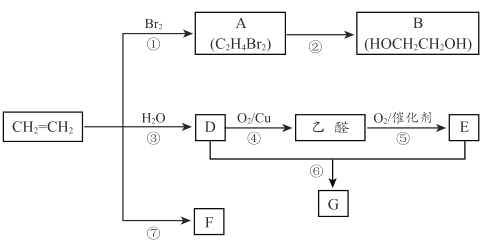
(1)反应①的化学方程式是 ____________________。
(2)B的官能团是_______________。
(3)反应④的化学方程式是_________________。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F 的结构简式是__________。
(5)E的分子式是 C2H4O2能使紫色石蕊试液变红; G 是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取 G, 装置如图所示。
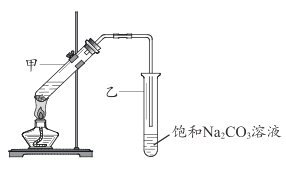
i.甲试管中反应的化学方程式是 __________;反应类型是_________。
ii.分离出试管乙中油状液体用到的主要仪器是___________________。
iii.如果将 4. 6g D 和 3g E 在催化剂条件下发生上述反应 ,充分反应后,如果实际产率为60%,实际得到G 的质量是__________ g。(已知:实际产率= 实际得到质量/理论计算质量)
(6)丙烯( CH3CH = CH2 ) 与乙烯互为同系物,在催化剂、加热条件下与O2 反应生成一种重要的化工原料丙烯酸( CH2= CHCOOH )。下列关于丙烯酸的说法正确的是 ________。
a.与乙酸互为同系物
b.能发生加成、酯化、氧化反应
c.能与 NaHCO3溶液反应生成 CO2
d.一定条件下能发生加聚反应,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
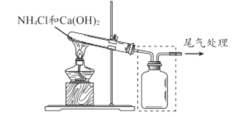
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
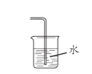
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
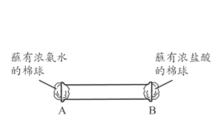
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
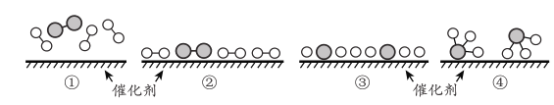
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )

A.气态氢化物稳定性:R>Q
B.元素T的离子半径>元素R的离子半径
C.与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键
D.Q可形成多种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
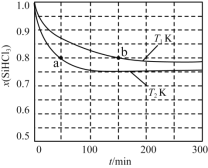
A. 该反应为放热反应,v正,a<v逆,b
B. 化学平衡状态时2v消耗(SiHCl3)=v消耗(SiCl4)
C. 当反应进行到a处时,v正/v逆=16/9
D. T2 K时平衡体系中再充入1 mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
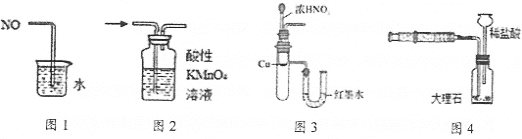
A.图1可用于吸收多余的NO
B.图2可用于检验SO2的漂白性
C.图3可用于说明铜与浓硝酸反应的能量变化
D.图4可用于测定CO2的生成速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com