
【题目】在一定条件下,将3molA和1molB两种气体混合于2L恒容密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2min末该反应达平衡,生成0.8molD,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
xC(g)+2D(g)。2min末该反应达平衡,生成0.8molD,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
A.x=2B.2min内B的反应速率为0.2 mol·L-1·min-1
C.A的转化率为40%D.若混合气体的密度不变,则表明该反应已达到平衡状态
【答案】C
【解析】
A、平衡时生成的C的物质的量为0.2mol·L-1×2L=0.4mol,物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A错误;
B、依据化学平衡三段式列式计算
3A(g)+B(g)![]() C(g)+2D(g)
C(g)+2D(g)
起始量(mol·L-1) 1.5 0.5 0 0
变化量(mol·L-1) 0.6 0.2 0.2 0.4
平衡量(mol·L-1) 0.9 0.3 0.2 0.4
2min内B的反应速率为v(D)=![]() =0.1 mol·L-1·min-1,故B错误;
=0.1 mol·L-1·min-1,故B错误;
C、A的转化率为![]() ×100%=40%,故C正确;
×100%=40%,故C正确;
D、因为容器体积不变,而反应前后气体质量守恒,则密度始终不变,则混合气体的密度不变时不能说明反应达到平衡状态,故D错误;
故选C。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
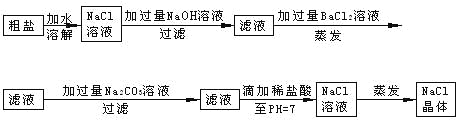
试简要说明:
(1)加入过量BaCl2的溶液的原因___________________。
(2)加入过量Na2CO3的溶液的原因_________________________。
(3)滴加稀盐酸直至pH=7的目的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧1g乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ, 则这一反应的热化学反应方程式为( )
A. 2C2H2(g)+ 5O2(g) ═4CO2(g)+ 2H2O(l) ΔH= +50kJ/mol
B. C2H2(g)+ 5/2O2(g)═2CO2(g)+ H2O(l) ΔH= +1300kJ/mol
C. 2C2H2+ 5O2═4CO2+ 2H2O ΔH=-2600kJ
D. 2C2H2(g)+ 5O2(g)═4CO2(g)+ 2H2O(l) ΔH=-2600kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向0.1mol/L 100mL CH3COONa的溶液中再加0.1mol CH3COONa固体后c(CH3COO-)/c(Na+)变大
B.向0.1mol/L的二元弱酸盐Na2A中不断通入HCl(g),则c(H+)/c(H2A)先变大后变小
C.已知:FeCl3(aq)+ 3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
D.室温时,0.1mol/L NH4HCO3溶液pH=8.1,则Ka1(H2CO3) >Kb(NH3·H2O)>Ka2(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为__________,未成对电子数为________________。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①与BH4-互为等电子体的阳离子的化学式为_____。
②H、B、Ti原子的第一电离能由小到大的顺序为_____。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
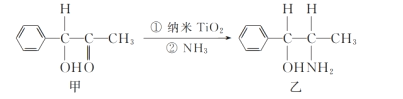
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是________________。
(5)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____,HSCN结构有两种,已知硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 可用作食盐的抗结剂,高温下
可用作食盐的抗结剂,高温下![]() 会分解生成
会分解生成![]() 、KCN、
、KCN、![]() 、
、![]() C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;
C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;![]() 中,铁原子不是采用
中,铁原子不是采用![]() 杂化的理由是______。
杂化的理由是______。
(2)![]() 气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;
气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;![]() 的三聚体环状结构如图1所示,该结构中
的三聚体环状结构如图1所示,该结构中![]() 键长有a、b两类,b的键长大于a的键长的可能原因为______。
键长有a、b两类,b的键长大于a的键长的可能原因为______。

(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
①下列微粒中存在“离域![]() 键”的是______;
键”的是______;
A.![]()
![]()
![]()
![]()
②![]() 分子中大
分子中大![]() 键可以表示为______;
键可以表示为______;
(4)铁、钾两种单质的堆积方式剖面图分别如图2、图3所示。铁晶体中原子的空间利用率为______![]() 用含
用含![]() 的式子表示
的式子表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).用合成气生成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
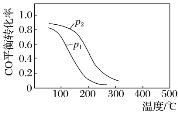
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH________(填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:________________________。
③下列说法正确的是________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=__________________。
⑤ 200 ℃时,该反应的平衡常数K=________。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡________(填“正向”“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的说法不正确的是
A.高炉炼铁、生产普通硅酸盐水泥和普通玻璃都要用到的一种原料是石灰石
B.工业上常以电解饱和食盐水为基础制取氯气
C.纯碱在玻璃、肥皂、食品等工业中有着广泛的应用
D.工业上利用焦炭与二氧化硅在高温下反应可直接制得高纯度的硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com