
【题目】(1)某第三周期金属元素R的部分电离能情况如图Ⅰ所示,则R元素位于正确表第____族,其基态原子第二能层电子排布图为_____________________。
图Ⅱ中 A、B、C、D是四种不同主族元素的气态氢化物,其中A比B分子沸点高的可能原因是_________。

图Ⅱ中C物质能与第二周期中的另一种元素的氢化物通过配位键相互作用得到化合物X,X是一种储氢材料,且X是乙烷的等电子体,加热X会缓慢释放H2同时生成化合物Y,Y又是乙烯的等电子体,则化合物C的VSEPR模型是__________,X的结构式为__________(标明配位键)。
(2)已知Ti3+可形成配位数为6的配合物。
现有钛的两种配合物,组成皆为TiCl3·6H2O,一种为紫色,另一种为绿色,现取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入AgNO3溶液充分反应,产生白色沉淀;测得绿色物质得到的沉淀质量是紫色物质得到的沉淀质量的2/3。则原绿色配合物的化学式为_____________,原紫色配合物的化学式为_____________。
(3)由某原子构成的晶胞,己知晶胞密度为ρg/cm3,边长为anm。若该原子半径为(![]() )anm,则该晶胞类型为______________;该原子的摩尔质量表达式为______________。
)anm,则该晶胞类型为______________;该原子的摩尔质量表达式为______________。
【答案】 ⅡA ![]() 水分子间的氢键数目比HF分子间多 面体形
水分子间的氢键数目比HF分子间多 面体形 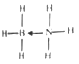 [TiCl(H2O)5]Cl2H2O [Ti(H2O)6]Cl3 面心立方晶胞 (ρa3NA/4)×10-21
[TiCl(H2O)5]Cl2H2O [Ti(H2O)6]Cl3 面心立方晶胞 (ρa3NA/4)×10-21
【解析】(1)由短周期某主族元素R的电离能可知,由第二电离能到第三电离能变化较大,则R最外层只有2个电子,失去2个电子后为稳定结构,再失去1个电子需要的能量较大,所以该元素R为ⅡA元素,R元素可能是Mg,其基态原子的电子排布式是1s22s22p63s2,其基态原子第二能层电子排布图为![]() H2O分子中的O与周围H2O分子中的两个H原子生成两个氢键,而HF分子中的F原子只能形成一个氢键,氢键越多,熔沸点越高,所以H2O熔沸点高,图Ⅱ中C为氨气,氨气分子中,NH3中N原子成3个σ键,有一对未成键的孤对电子,价层电子对数=3+
H2O分子中的O与周围H2O分子中的两个H原子生成两个氢键,而HF分子中的F原子只能形成一个氢键,氢键越多,熔沸点越高,所以H2O熔沸点高,图Ⅱ中C为氨气,氨气分子中,NH3中N原子成3个σ键,有一对未成键的孤对电子,价层电子对数=3+![]() (5-3×1)=4,所以采取sp3杂化,VSEPR模型是四面体形;NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH3NH3,Y是乙烯的等电子体,应为BH2=NH2,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为
(5-3×1)=4,所以采取sp3杂化,VSEPR模型是四面体形;NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH3NH3,Y是乙烯的等电子体,应为BH2=NH2,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为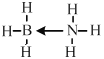 ,故答案为:ⅡA;
,故答案为:ⅡA;![]() ;H2O分子之间形成的氢键数目比HF分子之间多;四面体形;
;H2O分子之间形成的氢键数目比HF分子之间多;四面体形; ;
;
(2)配合物中只有外界才能电离出自由移动的离子,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀,说明两种物质外界中都含有氯离子;
测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的![]() ,说明绿色物质外界中氯离子是紫色物质的
,说明绿色物质外界中氯离子是紫色物质的![]() ,所以绿色物质化学式外界中含有两个氯离子,化学式为[TiCl(H2O)5]Cl2H2O、紫色物质化学式外界中含有3个氯离子,化学式为[Ti(H2O)6]Cl3,故答案为:[TiCl(H2O)5]Cl2H2O;[Ti(H2O)6]Cl3;
,所以绿色物质化学式外界中含有两个氯离子,化学式为[TiCl(H2O)5]Cl2H2O、紫色物质化学式外界中含有3个氯离子,化学式为[Ti(H2O)6]Cl3,故答案为:[TiCl(H2O)5]Cl2H2O;[Ti(H2O)6]Cl3;
(3)根据晶胞边长为anm,原子半径为(![]() )anm,说明该原子为面心上,则该晶胞为面心立方晶胞,1mol晶胞中含有原子的数目=8×
)anm,说明该原子为面心上,则该晶胞为面心立方晶胞,1mol晶胞中含有原子的数目=8×![]() +6×
+6×![]() =4,1mol晶胞的质量为4Mg,则晶胞密度为ρg/cm3=
=4,1mol晶胞的质量为4Mg,则晶胞密度为ρg/cm3=![]() ,解得M=(ρa3NA/4)×10-21,故答案为:面心立方晶胞;(ρa3NA/4)×10-21。
,解得M=(ρa3NA/4)×10-21,故答案为:面心立方晶胞;(ρa3NA/4)×10-21。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】分子式为C4H10O的有机化合物A。按要求完成下列问题:(每空1分,共5分)
(1)若A能在催化剂作用下连续氧化生成羧酸,请写出它可能的结构简式为 、 。
(2)当C原子与4个不同的原子或基团相连时该碳原子称作“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构简式为________________。
(3)A(C4H10O)![]() B(C4H8),已知:A分子中有三个甲基。A与浓HBr溶液一起共热生成H
B(C4H8),已知:A分子中有三个甲基。A与浓HBr溶液一起共热生成H
写出A、H的结构简式 、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如下:

已知:I. M代表E分子结构中的一部分
II. ![]()
请回答下列问题:
(1) 芳香烃A的质谱图如下图,其名称是____________________。

(2) E中所含官能团的名称是________________________。
(3)由A制备F的反应类型是____________________。
(4)C能与NaHCO3溶液反应,反应①的化学方程式是____________________。
(5)反应②中试剂ⅱ是_______________。(填序号)
a.高锰酸钾酸性溶液 b.氢氧化钠溶液
(6)写出反应③的化学反应方程式____________。
(7) J有多种同分异构体,写出其中所有符合下列条件的结构简式_______________。
a.为苯的邻位二元取代物,且与FeCl3可以发生显色反应
b.与J具有相同的官能团,且能发生银镜反应
(8)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国在超导研究方面居世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第6周期ⅢA族,下列对铊的性质推导可能正确的是( )
①铊是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+的强
④单质能跟稀HNO3反应生成硝酸盐
A. ①④ B. ②③ C. 只有① D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的电子层数相同,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则三种元素的原子序数的大小顺序是( )
A. X>Y>Z B. Y>Z>X
C. X>Z>Y D. Z>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. Na2O2与H2O反应:2![]() +2H2O4OH-+O2↑
+2H2O4OH-+O2↑
B. 金属钠投入水中:Na+2H2O=Na++OH-+H2↑
C. CaCO3与醋酸溶液反应:CaCO3+2H+Ca2++CO2↑+H2O
D. KAl(SO4)2溶液与氨水反应:Al3++3NH3·H2OAl(OH)3↓+3N![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不能得到氢氧化铝沉淀的是 ( )
A. 硫酸铝溶液与过量的氨水混合B. 氯化铝溶液中加入几滴烧碱溶液
C. 偏铝酸钠溶液中加入过量的盐酸D. 偏铝酸钠溶液中通入过量的二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com