
| A、化学反应 | B、可逆反应 |
| C、离子反应 | D、气态物质的反应 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、加入少量NaOH固体,溶液中c(OH-)减少 |
| B、通入少量HCl气体,平衡向正反应方向移动 |
| C、加水,反应速率增大,平衡向逆反应方向移动 |
| D、加入少量NH4Cl固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入硫酸当溶液的pH=7时,c(SO42-)>c(NH4+) | ||
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2 | ||
| C、0.1mol/L的醋酸溶液加水稀释后,溶液中所有离子浓度都减小 | ||
D、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 加热 |
| A、都是置换反应 |
| B、都是氧化还原反应 |
| C、反应中钛元素都被还原 |
| D、加热时金属钛和氩气(Ar)能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、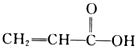 |
B、 |
| C、CH2=CH-CH2OH |
D、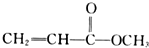 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、铊能生成+3价的离子 |
| C、Tl3+的氧化能力比Al3+强 |
| D、氢氧化铊的碱性比氢氧化铝强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①②③ |
| C、①③⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
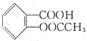 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com