
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJmol-1
一种工业合成氨的简易流程图如图:
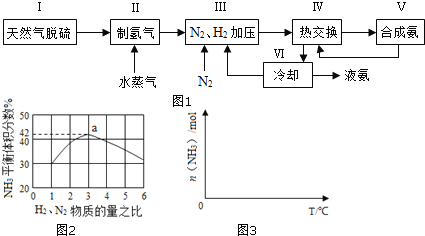
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJmol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
【答案】2NH4HS+O2=2NH3·H2O+2S↓ a 90% 14.5% 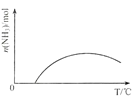 Ⅳ 分离液氨,未反应的氮气和氢气循环使用
Ⅳ 分离液氨,未反应的氮气和氢气循环使用
【解析】
![]() 与
与![]() 发生氧化还原反应;
发生氧化还原反应;
(2)根据影响反应速率的因素、影响平衡移动的因素分析能提高平衡体系中H2百分含量,又能加快反应速率的方法;利用“三段式”计算CO转化率;
(3)利用“三段式”计算a点N2的平衡体积分数;
(4)随着反应的进行,![]() 的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,
的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,![]() 的物质的量逐渐减小;
的物质的量逐渐减小;
![]() 分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体;把平衡混合气体中氮气和氢气重新循环使用;
分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体;把平衡混合气体中氮气和氢气重新循环使用;
![]() 把
把![]() 氧化为S,化学方程式是
氧化为S,化学方程式是![]() ;
;
![]() 、反应
、反应![]() 为吸热反应,升高温度,反应速率加快,平衡向右移动,
为吸热反应,升高温度,反应速率加快,平衡向右移动,![]() 的百分含量增大,故a正确;
的百分含量增大,故a正确;
b、增大水蒸气浓度,![]() 的百分含量减小,故b错误;
的百分含量减小,故b错误;
c、加入催化剂,平衡不移动,![]() 的百分含量不变,故c错误;
的百分含量不变,故c错误;
d、降低压强,反应速率减小,故d错误;
设CO的转化量为x
![]()
转化量![]()
![]() 0
0 ![]()
转化量![]() x x x
x x x
平衡量![]()
![]() x
x ![]()
![]() ,则
,则![]() ,可得CO转化率
,可得CO转化率![]() ;
;
![]() 根据图1可知a点
根据图1可知a点![]() 与
与![]() 的投料比为3,平衡时
的投料比为3,平衡时![]() 体积分数为
体积分数为![]() ,设
,设![]() 物质的量为3amol,
物质的量为3amol,![]() 物质的量为amol,
物质的量为amol,![]() 转化的物质的量为x,则
转化的物质的量为x,则 ![]()
转化量![]() a 3a 0
a 3a 0
转化量![]() x 3x 2x
x 3x 2x
平衡量![]()
![]()
![]() 2x
2x
![]() ,解得
,解得![]() ,则
,则![]() 的平衡体积分数
的平衡体积分数![]() ;
;
![]() 随着反应的进行,
随着反应的进行,![]() 的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,
的物质的量逐渐增大,当反应平衡后,升高温度,平衡向左移动,![]() 的物质的量逐渐减小,可画出图象为:
的物质的量逐渐减小,可画出图象为: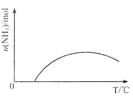
![]() ;
;
![]() 分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率。
分析流程合成氨放热,通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,11.2 L H2O 中含有的氧原子数为0.5NA
B.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
C.16 g O2与16 g O3含有的氧原子数目相等
D.常温常压下,11.2 L氯气所含原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
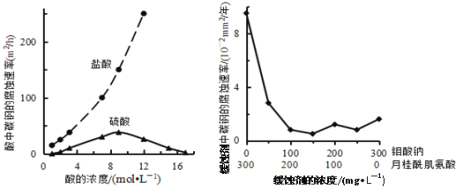
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机中生成 NO 的反应为:N2(g) + O2(g)![]() 2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(N2)/mol·L-1 | 0.46 | 0.46 | 0.92 |
c(O2)/mol·L-1 | 0.46 | 0.23 | 0.92 |
下列判断不正确的是
A.起始时,反应速率:丙>甲>乙B.平衡时,N2 的转化率:甲>乙
C.平衡时,c(NO):甲=丙>乙D.平衡时,甲中 c(N2)= 0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:![]() (正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
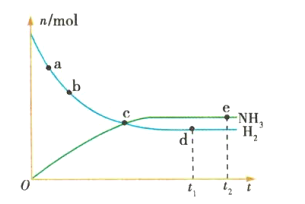
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2℃时,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示。下列说法正确的是( )
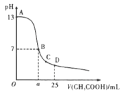
A.在A、B间任一点的溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离平衡常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol/L
D.D点对应的溶液中,存在关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) =N2(g)+3H2(g) ΔH,若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol1),则上述反应的ΔH=________kJ·mol1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
不同催化剂存在下,氨气分解反应活化能最大的是________(填写催化剂的化学式)。
(3) 电化学法也可合成氨。如图是用低温固体质子导体作为电解质,用PtC3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
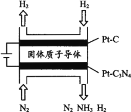
PtC3N4电极反应产生NH3的电极反应式________。
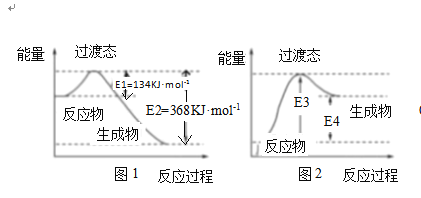
(4)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图
①试写出NO2和CO反应的热化学方程式:______
②在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=______kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com