
下列溶液能与镁反应生成氢气的是
A.氯化铵溶液 B.氢氧化钠溶液
C.碳酸钾溶液 D.饱和石灰水
科目:高中化学 来源: 题型:
用下列实验装置完成相应实验,正确的是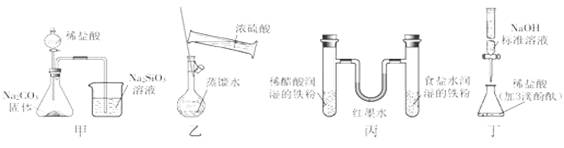
A.甲用于证明非金属性强弱:Cl>C>Si B.乙用于配制一定物质的量浓度的硫酸溶液
C.丙用于模拟生铁的电化学腐蚀 D.丁用于测定某稀盐酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学进行实验研究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是 。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于是试管中, 。 | |
| 步骤4: |
(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250ml 约0.1mol•L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L- 1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
③ 计算Ba(OH)2·8H2O的质量分数= (只列出算式,不做运算)
(4)室温下, (填“能”或“不能”) 配制1.0 mol•L-1Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
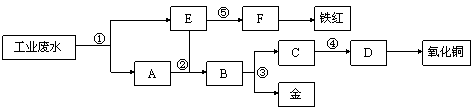
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤  ;
;
(2)写出①处发生反应的离子方程式 ;写 出③处发生反应的化学方程式 ;
出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如下图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
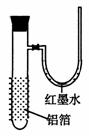
A 实验中发生的反应都是氧化还原反应
B 铝是一种较活泼的金属
C 铝与氧气反应放出大量的热量
D 铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列金属冶炼的反应原理,错误的是( )
A、2NaCl(熔融) 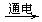 2Na + Cl2↑
2Na + Cl2↑
B、MgO + H2 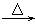 Mg + H2O
Mg + H2O
C、Fe3O4 + 4CO 3Fe + 4CO2
3Fe + 4CO2
D、2HgO 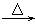 2Hg + O2↑
2Hg + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏伽德罗常数,下列说法中不正确的是( )
A、一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B、1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C、0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D、125gCuSO4•5H2O晶体中含有0.5NA个Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com